Cho 0,1 mol andehit A có mạch cacbon không phân nhánh tác dụng hoàn toàn với hidro, thấy cần dùng 6,72 lit H2 (đkc) và thu được chất hữu cơ B. Cho lượng B này tác dụng với Na dư thì thu được 2,24 lit khí (đkc). Mặt khác, nếu lấy 8,4 gam A tác dụng dung dịch AgNO3/NH3 dư thì thu được hỗn hợp X gồm 2 muối và 43,2 gam Ag.
a. Xác định CTCT A, B.
b. Tính khối lượng hỗn hợp muối.
Cho 0,1 mol andehit A có mạch cacbon không phân nhánh tác dụng hoàn toàn với hidro, thấy cần dùng 6,72 lit H2 (đkc) và thu được chất hữu cơ B. Cho lượng B này tác dụng với Na dư thì thu được 2,24 lit khí (đkc). Mặt khác, nếu lấy 8,4 gam A tác dụng dung dịch AgNO3/NH3 dư thì thu được hỗn hợp X gồm 2 muối và 43,2 gam Ag.
a. Xác định CTCT A, B.
b. Tính khối lượng hỗn hợp muối.
Quảng cáo
Trả lời:
Số mol H2 phản ứng: nH2 = 6,72/22,4 = 0,3 mol ⇒ trong A có 3 liên kết π.
Số mol H2 sinh ra khi cho B tác dụng Na: nH2 sinh ra = 0,1 mol ⇒ trong A có 2 nhóm CHO
Vậy A là anđehit không no 2 chức ⇒ CTPT là CnH2n-2(CHO)2
Phương trình phản ứng
CnH2n-2(CHO)2 + 4AgNO3 + 4NH3 + H2O → CnH2n-2(COONH4)2 + 2NH4NO3 + 4Ag
0,1 0,4
Phân tử khối của A: MA = 8,4/0,1 = 84 ⇒ n = 2
Vậy CTCT của A và B lần lượt là: OHC-CH=CH-CHO và HO-2HC-CH=CH-CH2OH
b. Khối lượng hỗn hợp muối thu được là (muối gồm C2H3(COONH4)2 và NH4NO3
m = 151.0,1 + 0,2.80 = 31,1 g
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Hóa học 11 dùng cho cả 3 bộ sách Kết nối, Cánh diều, Chân trời sáng tạo VietJack - Sách 2025 ( 58.000₫ )
- Trọng tâm Sử, Địa, GD KTPL 11 cho cả 3 bộ Kết nối, Chân trời, Cánh diều VietJack - Sách 2025 ( 38.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Gọi số mol ban đầu của andehit focmic là: a mol
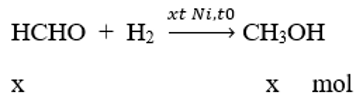
Hỗn hợp sau phản ứng ngưng tụ gồm: CH3OH, HCHO hòa tan vào nước.
Khối lượng bình tăng: m↑ = 11,8 = (a-x).30 + 32.x = 30a + 2x
Anđehit tác dụng với AgNO3/NH3: nHCHO = nAg/4 = 0,05 mol = a – x (2)
Từ 1, 2 ⇒ x = 0,32 và a = 0,37; ⇒ mCH3OH = 0,32.32 = 10,24 g
Câu 2
Lời giải
Đáp án: C
R–CHO + H2 −tº, Ni→ R–CH2OH
nandehit = nH2 = (15,2-14,6)/2 = 0,3 mol ⇒ Mandehit = 14,6/0,3 = 146/3
⇒ 2 andehit là C2H5CHO và CH3CHO; nC2H5CHO : nCH3CHO = 1 :2
⇒ nC2H5CHO = 0,1.58 = 5,8 g
Câu 3
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.