Sử dụng máy tính cầm tay để tính:
a) pH của các dung dịch có nồng độ H+ lần lượt là: 0,01 M; 0,5 M và 1 M.
b) Nồng độ H+ của các dung dịch có pH lần lượt là 2,0; 7,4 và 14.
Sử dụng máy tính cầm tay để tính:
a) pH của các dung dịch có nồng độ H+ lần lượt là: 0,01 M; 0,5 M và 1 M.
b) Nồng độ H+ của các dung dịch có pH lần lượt là 2,0; 7,4 và 14.
Quảng cáo
Trả lời:
a) Áp dụng công thức pH = -log[H+] ta có pH của các dung dịch được thể hiện trong bảng sau:
|
Nồng độ (M) |
0,01 |
0,5 |
1 |
|
pH |
2 |
0,3 |
0 |
b) Áp dụng công thức [H+] = 10-pH ta có nồng độ H+ của các dung dịch được thể hiện trong bảng sau:
|
pH |
2 |
7,4 |
14 |
|
Nồng độ (M) |
0,01 |
3,98.10-8 |
10-14 |
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Hóa học 11 dùng cho cả 3 bộ sách Kết nối, Cánh diều, Chân trời sáng tạo VietJack - Sách 2025 ( 58.000₫ )
- Trọng tâm Sử, Địa, GD KTPL 11 cho cả 3 bộ Kết nối, Chân trời, Cánh diều VietJack - Sách 2025 ( 38.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
NaOH + HCl → NaCl + H2O
Ta có: VHCl. CHCl = VNaOH. CNaOH
Lời giải
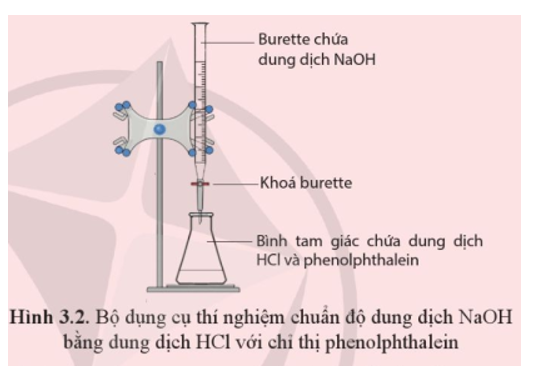
Hiện tượng: Ban đầu dung dịch trong bình tam giác không có màu. Mở khoá burette để nhỏ từ từ từng giọt dung dịch NaOH vào bình tam giác, đồng thời lắc đều bình thấy dung dịch trong bình chuyển từ không màu sang hồng.
Phương trình hoá học: NaOH + HCl → NaCl + H2O.
Xác định nồng độ dung dịch NaOH: Học sinh tự xác định theo kết quả chuẩn độ trên lớp.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.