a) Gọi tên hydrocarbon sau theo danh pháp thay thế:
CH≡C-CH2-CH=CH2
b) Khi cho hydrocarbon trên tác dụng với bromine trong CCl4 ở -20 °C thu được 4,5-dibromopent-1-yne theo phương trình phản ứng:
4,5-dibromopent-1 -yne
Nhận xét về tốc độ phản ứng cộng bromine vào liên kết đôi và liên kết ba. Rút ra kết luận.
a) Gọi tên hydrocarbon sau theo danh pháp thay thế:
CH≡C-CH2-CH=CH2
b) Khi cho hydrocarbon trên tác dụng với bromine trong CCl4 ở -20 °C thu được 4,5-dibromopent-1-yne theo phương trình phản ứng:
4,5-dibromopent-1 -yne
Nhận xét về tốc độ phản ứng cộng bromine vào liên kết đôi và liên kết ba. Rút ra kết luận.
Câu hỏi trong đề: Giải SBT Hóa học 11 CTST Bài Ôn tập chương 4 có đáp án !!
Quảng cáo
Trả lời:
a) Khi hydrocarbon vừa có liên kết đôi, vừa có liên kết ba, chú ý đánh số ưu tiên liên kết đôi hơn liên kết ba. Tên hydrocarbon đã cho là:
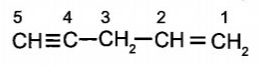
pent-1-ene-4-yne
b) Dựa vào phương trình phản ứng:
CH≡C-CH2-CH = CH2 + Br - Br CH≡C-CH-CHBr-CH2Br
pent-1 -ene-4-yne 4,5-dibromopent-1 -yne
thì tốc độ cộng bromine vào liên kết đôi lớn hơn rất nhiều so với vào liên kết ba. Điều này cũng phù hợp khi ethylene và acetylene đều có khả năng làm mất màu nước bromine ở ngay điều kiện thường, nhưng tốc độ mất màu của ethylene nhanh hơn so với acetylene. Như vậy alkene dễ cho phản ứng cộng (X2, HX, H2O) hơn so với alkyne.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Hóa học 11 dùng cho cả 3 bộ sách Kết nối, Cánh diều, Chân trời sáng tạo VietJack - Sách 2025 ( 58.000₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 11 VietJack - Sách 2025 theo chương trình mới cho 2k8 ( 45.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Khối lượng ethylene cần thiết:
Lời giải
Nhiệt lượng cần cung cấp trên lí thuyết để đun nóng 1 L nước hay 1 000 gam nước từ 25 °C lên 100 °C là:
Q = 1 000×(100 - 25)×4,2 = 315 000 (J) = 315 (kJ).
Khối lượng propane trên lí thuyết cần là:
Khối lượng propane thực tế cần lấy:
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.