Trong thực tế, trong quá trình điện phân dung dịch sodium chloride bão hòa, sau một thời gian, dung dịch NaCl tại anode được gọi là “nước muối nghèo” và được đưa ra khỏi bể điện phân; đồng thời dung dịch NaCl bão hòa mới được bổ sung vào để tiếp tục quá trình điện phần (như Hình 17.1). Hãy giải thích việc làm này, viết phương trình hóa học (nếu có). Biết rằng, dung dịch tại bể anode có pH = 3; \[E_{C{l_2}/2C{l^ - }}^o\]= 1,36 V; \[E_{{O_2},4{H^ + }/2{H_2}O\;}^o\]= 1,23 V.
Nước muối bão hòa có nồng độ 300 g L–1 , trong khi đó “nước muối nghèo” có nồng độ 220 g L-1. Với mỗi lít nước muối bão hòa ban đầu thì thu được bao nhiêu gam sodium hydroxide, nếu hiệu suất của quá trình là 80%.
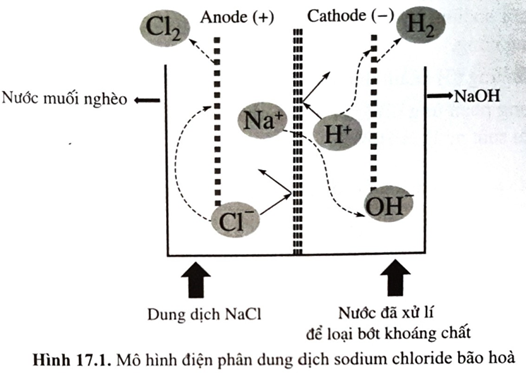
Trong thực tế, trong quá trình điện phân dung dịch sodium chloride bão hòa, sau một thời gian, dung dịch NaCl tại anode được gọi là “nước muối nghèo” và được đưa ra khỏi bể điện phân; đồng thời dung dịch NaCl bão hòa mới được bổ sung vào để tiếp tục quá trình điện phần (như Hình 17.1). Hãy giải thích việc làm này, viết phương trình hóa học (nếu có). Biết rằng, dung dịch tại bể anode có pH = 3; \[E_{C{l_2}/2C{l^ - }}^o\]= 1,36 V; \[E_{{O_2},4{H^ + }/2{H_2}O\;}^o\]= 1,23 V.
Nước muối bão hòa có nồng độ 300 g L–1 , trong khi đó “nước muối nghèo” có nồng độ 220 g L-1. Với mỗi lít nước muối bão hòa ban đầu thì thu được bao nhiêu gam sodium hydroxide, nếu hiệu suất của quá trình là 80%.

Quảng cáo
Trả lời:
Do thế khử chuẩn của nước (môi trường acid) xấp xỉ thế khử chuẩn của chlorine, nên khi nồng độ chloride giảm (trong nước muối nghèo) xảy ra phản ứng oxi hóa nước ở anode: 2H2O → O2 + 4H+ + 4e, cạnh tranh với phản ứng oxi hóa anion chloride làm giảm hiệu suất điện phân; đồng thời khí chlorine thu được sẽ bị lẫn khí oxygen. Do đó, dung dịch sodium chloride tại anode cần được “làm giàu” liên tục nhằm duy trì nồng độ bão hòa NaCl.
Khối lượng sodium hydroxide thu được ứng với mỗi lít nước muối bão hòa bị điện phân là: m = \(\frac{{300 - 220}}{{58,5}}.40.0,8 = 43,8gam.\)
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Sổ tay Hóa học 12 (chương trình mới) ( 18.000₫ )
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- Sổ tay lớp 12 các môn Toán, Lí, Hóa, Văn, Sử, Địa, KTPL (chương trình mới) ( 36.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
(a) Sai, sodium bị hòa tan nhanh chóng là do phản ứng ăn mòn hóa học và không sinh ra dòng điện.
(b) Đúng, dung dịch tạo thành có môi trường kiềm.
(c) Đúng, khí H2 thoát ra là một khí dễ cháy.
(d) Đúng.
Lời giải
Phát biểu đúng: (b); (c); (d).
Phát biểu (a) sai vì soda tan trong nước tạo môi trường kiềm.
Phát biểu (e) sai vì baking soda không được dùng trong việc tẩy rửa lớp dầu, mỡ bám vào bồn rửa.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.