Nước tự nhiên được sử dụng làm nguồn nước uống có nhiều loại khoáng chất hòa tan như magnesium (Mg2+), sodium (Na+) và calcium (Ca2+). Nồng độ của các loại khoáng chất này cần được xử lý và kiểm soát một cách nghiêm ngặt để không ảnh hưởng tới sức khỏe của người sử dụng.
Mẫu nước uống cần được kiểm tra bằng phương pháp chuẩn độ EDTA Mg2+ (EDTA là ethylenediaminetetraacetic acid – một acid có khả năng liên kết với ion kim loại tạo thành phức chất hòa tan trong nước ngay cả ở pH trung tính) để xác định nồng độ của ion Mg2+. Thí nghiệm được tiến hành như sau:
Bước 1. Thêm 10 ml mẫu nước cần xác định nồng độ ion Ca2+ và Mg2+ vào bình erlen, thêm chỉ thị X.
Bước 2. Thêm chính xác 50 ml EDTA (tồn tại dưới dạng Y4−) có nồng độ 20 ppm (phần triệu) vào burret.
Bước 3. Tiến hành chuẩn độ cho tới khi nhìn thấy sự đổi màu bền của dung dịch trong bình erlen.
Biết: Chất chỉ thị X có khả năng hình thành phức chất với ion Mg2+ tạo thành dung dịch có màu tím, còn khi tồn tại trạng thái tự do thì có màu xanh lam. EDTA hình thành phức chất với ion Mg2+ với tỉ lệ phản ứng là 1 : 1.
Tiến hành chuẩn độ với 5 mẫu nước, thể tích của dung dịch EDTA đã tham gia chuẩn độ dược ghi trong bảng 1 như sau:

Nhận định nào dưới đây là đúng về hiện tượng xảy ra trong bình erlen tại điểm kết thúc chuẩn độ?
Nước tự nhiên được sử dụng làm nguồn nước uống có nhiều loại khoáng chất hòa tan như magnesium (Mg2+), sodium (Na+) và calcium (Ca2+). Nồng độ của các loại khoáng chất này cần được xử lý và kiểm soát một cách nghiêm ngặt để không ảnh hưởng tới sức khỏe của người sử dụng.
Mẫu nước uống cần được kiểm tra bằng phương pháp chuẩn độ EDTA Mg2+ (EDTA là ethylenediaminetetraacetic acid – một acid có khả năng liên kết với ion kim loại tạo thành phức chất hòa tan trong nước ngay cả ở pH trung tính) để xác định nồng độ của ion Mg2+. Thí nghiệm được tiến hành như sau:
Bước 1. Thêm 10 ml mẫu nước cần xác định nồng độ ion Ca2+ và Mg2+ vào bình erlen, thêm chỉ thị X.
Bước 2. Thêm chính xác 50 ml EDTA (tồn tại dưới dạng Y4−) có nồng độ 20 ppm (phần triệu) vào burret.
Bước 3. Tiến hành chuẩn độ cho tới khi nhìn thấy sự đổi màu bền của dung dịch trong bình erlen.
Biết: Chất chỉ thị X có khả năng hình thành phức chất với ion Mg2+ tạo thành dung dịch có màu tím, còn khi tồn tại trạng thái tự do thì có màu xanh lam. EDTA hình thành phức chất với ion Mg2+ với tỉ lệ phản ứng là 1 : 1.
Tiến hành chuẩn độ với 5 mẫu nước, thể tích của dung dịch EDTA đã tham gia chuẩn độ dược ghi trong bảng 1 như sau:

Nhận định nào dưới đây là đúng về hiện tượng xảy ra trong bình erlen tại điểm kết thúc chuẩn độ?
A. Không có hiện tượng gì xảy ra.
B. Dung dịch đổi màu từ màu tím sang màu xanh lam.
C. Dung dịch đổi màu từ xanh lam sang màu tím.
Quảng cáo
Trả lời:
Đáp án đúng là B
Phương pháp giải
Dựa vào đoạn thông tin mô tả sự biến đổi màu sắc của chất chỉ thị X: Chất chỉ thị X có khả năng hình thành phức chất với ion Mg2+ tạo thành dung dịch có màu tím, còn khi tồn tại trạng thái tự do thì có màu xanh lam.
Lời giải
Ban đầu, khi trong bình erlen chỉ có ion Mg2+ và chất chỉ thị X thì dung dịch trong bình có màu tím. Nhưng trong quá trình tiến hành chuẩn độ, nồng độ ion Mg2+ tự do giảm do đã hình thành phức chất với EDTA. Cho đến thời điểm khi nồng độ ion Mg2+ tự do giảm về 0 thì chất chỉ thị chuyển màu sang xanh lam bền. Khi đó ta nhìn thấy và dừng quá trình chuẩn độ.
Câu hỏi cùng đoạn
Câu 2:
Ion Mg2+ trong nước cao gây ra hiện tượng nước cứng, gây ảnh hưởng nhiều đến đời sống. Bảng 2 cho biết thông số để phân loại nước cứng dựa nào nồng độ ion Mg2+ như sau:

Mẫu nước số 5 trong thí nghiệm chuẩn độ là
Ion Mg2+ trong nước cao gây ra hiện tượng nước cứng, gây ảnh hưởng nhiều đến đời sống. Bảng 2 cho biết thông số để phân loại nước cứng dựa nào nồng độ ion Mg2+ như sau:

Mẫu nước số 5 trong thí nghiệm chuẩn độ là
A. nước mềm.
B. nước hơi cứng.
Đáp án đúng là C
Phương pháp giải
Tính nồng độ ion Mg2+ tham gia phản ứng rồi phân loại nước cứng.
Lời giải
EDTA hình thành phức chất với ion Mg2+ với tỉ lệ phản ứng là 1 :
Mg2+ +Y4− → MgY2−
Nồng độ ion Mg2+ trong mẫu nước số 5 là :
Vậy mẫu nước số 5 có là nước cứng vừa phải.
Chọn đáp án C.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Tuyển tập 15 đề thi Đánh giá tư duy Đại học Bách Khoa Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia TP Hồ Chí Minh (2 cuốn) ( 140.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội, TP Hồ Chí Minh (2 cuốn) ( 150.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án đúng là ![]()
Phương pháp giải
Tìm giao điểm của tiệm cận xiên và tiệm cận đứng.
Lời giải
Ta có ![]() .
.
Khi đó đồ thị hàm số có tiệm cận xiên là ![]() và tiệm cận đứng là
và tiệm cận đứng là ![]() .
.
Thay vào ta có ![]() . Vậy tọa độ giao điểm là
. Vậy tọa độ giao điểm là ![]()
Câu 2
A. Hợp tác toàn diện với các nước xã hội chủ nghĩa.
B. Thúc đẩy quan hệ với các nước Đông Nam Á.
C. Thiết lập quan hệ với các tổ chức quốc tế và các nước khác.
Lời giải
Đáp án đúng là D
Phương pháp giải
- Cần nắm vững bối cảnh lịch sử và đường lối đối ngoại của Việt Nam trong giai đoạn 1975-1985.
- Chú ý về các hoạt động đối ngoại của Việt Nam trong giai đoạn này.
- Phân tích tính đúng sai của các đáp án.
Lời giải
A loại vì Hợp tác toàn diện với các nước xã hội chủ nghĩa. Đây là một hoạt động chính trong chính sách đối ngoại của Việt Nam giai đoạn 1975-1985. Việt Nam tăng cường quan hệ với Liên Xô và các nước xã hội chủ nghĩa khác để tranh thủ sự giúp đỡ về kinh tế và chính trị, khắc phục hậu quả chiến tranh và xây dựng đất nước.
B loại Thúc đẩy quan hệ với các nước Đông Nam Á. Việt Nam có chủ trương thiết lập quan hệ hữu nghị và hợp tác với các nước trong khu vực. Tuy nhiên, do vấn đề Campuchia, quan hệ với các nước ASEAN gặp nhiều khó khăn và căng thẳng. Vì vậy, đây là một mục tiêu khó khăn chứ không phải là một hoạt động nổi bật trong giai đoạn này.
C loại vì Thiết lập quan hệ với các tổ chức quốc tế và các nước khác. Việt Nam nỗ lực tham gia vào các tổ chức quốc tế và mở rộng quan hệ với các nước không thuộc hệ thống xã hội chủ nghĩa. Tuy nhiên, do tình hình quốc tế phức tạp và bị cấm vận, hoạt động này gặp nhiều hạn chế.
D chọn vì Đứng dưới ô bảo hộ hạt nhân của Liên Xô. Đây là điều không chính xác. Việt Nam không "đứng dưới ô bảo hộ hạt nhân" của Liên Xô theo nghĩa chính thức. Mặc dù Việt Nam nhận được sự giúp đỡ to lớn từ Liên Xô, nhưng Việt Nam luôn giữ vững độc lập, tự chủ trong đường lối đối ngoại. Việc "bảo hộ hạt nhân" là một khái niệm liên quan đến các hiệp ước quân sự chính thức, mà giữa Việt Nam và Liên Xô không có hiệp ước nào như vậy.
Câu 3
A. đi xuống với gia tốc 9,775m/s2.
B. đi lên với gia tốc 9,775m/s2.
C. đi xuống với gia tốc 215m/s2.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
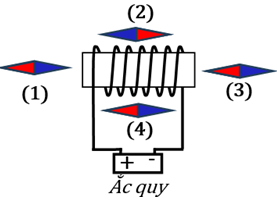
A. nam châm (1).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. Gắn với tìm hiểu bản sắc văn hoá các dân tộc.
B. Du lịch thể thao, tham quan hệ sinh thái cao nguyên.
C. Du lịch đô thị gắn với tham quan thắng cảnh biển.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.