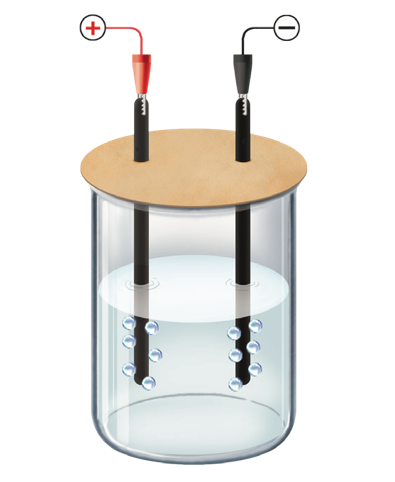
Người ta mạ nickel lên mặt vật kim loại bằng phương pháp mạ điện, dung dịch điện phân chứa \[NiS{O_4},\]cực dương là Ni kim loại, cực âm là vật kim loại cần mạ. Nếu dòng điện có cường độ 1,5 A chạy qua dung dịch trong 2 giờ thì khối lượng nickel được mạ lên vật là bao nhiêu? (Cho biết khối lượng mol của Ni = 58,7 g/mol, hằng số Faraday F = 96500 C/mol, hiệu suất quá trình điện phân là 100%). (Làm tròn kết quả đến hàng phần mười)
Quảng cáo
Trả lời:
Hướng dẫn giải
Đáp án đúng là: 3,3.
Ta có: \(I.t{\rm{ }} = {\rm{ }}{n_e}.F \Rightarrow {n_e} = \frac{{I.t}}{F} = \frac{{1,5.7200}}{{96500}} = 0,1119\,\,mol\)
Phương trình điện phân:
\[\begin{array}{l}N{i^{2 + }}\,\,\,\,\,\,\,\,\,\,\,\, + {\rm{ }}\,\,\,\,\,\,\,\,{\rm{ }}2e{\rm{ }}\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,{\rm{ }}Ni\\\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1119\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,\frac{{0,1119}}{2}{\rm{ }}mol\end{array}\]
m Ni mạ = \[\frac{{0,1119}}{2}.58,7 \approx 3,3{\rm{ }}g.\]
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Hướng dẫn giải
Đáp án đúng là: 1,64
Đổi: 20 cm = 0,2 m; 0,01 mm = 0,001 cm.
\(\begin{array}{l}S = 3,14 \times {(0,2)^2} = 0,1256\;{{\rm{m}}^2} = 1256\;{\rm{c}}{{\rm{m}}^2} \Rightarrow {V_{Ag}} = 1256.0,001 = 1,256(\;{\rm{c}}{{\rm{m}}^3}).\\ \Rightarrow {m_{Ag}} = 1,256.10,5 = 13,188\;({\rm{g)}} \Rightarrow {n_{Ag}} = \frac{{13,188}}{{108}} = 0,1222\;{\rm{mol}}{\rm{.}}\end{array}\)
Ta có: \(Q = {n_e}.F = I.t \Rightarrow t = \frac{{{n_e}.F}}{I} = \frac{{0,1222.96500}}{2} = 5896,5\,\,(s) \simeq 1,64\,(h).\)
Lời giải
Hướng dẫn giải
a. Đúng.
b. Sai. Trong công nghiệp Na được sản xuất bằng phương pháp điện phân nóng chảy.
c. Sai. Tại cathode xảy ra quá trình nhận electron.
d. Sai. Tại anode xảy ra quá trình nhường electron.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
A. Na+.
B. \[{\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}\].
C. \[{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}\].
D. \[{{\rm{K}}^{\rm{ + }}}\].
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.