Để mạ 5,0 g bạc lên một đĩa sắt khi điện phân dung dịch chứa 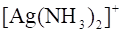 với dòng điện có cường độ 1,5 A không đổi cần thời gian t phút.
với dòng điện có cường độ 1,5 A không đổi cần thời gian t phút.
Cho biết:
- Quá trình khử tại cathode: 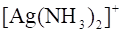 + 1e → Ag + 2NH3.
+ 1e → Ag + 2NH3.
- Điện lượng Q = It = ne. F, F = 96 500 C/mol.
Giá trị của t là bao nhiêu? (Làm tròn kết quả đến phần mười).
Để mạ 5,0 g bạc lên một đĩa sắt khi điện phân dung dịch chứa với dòng điện có cường độ 1,5 A không đổi cần thời gian t phút.
Cho biết:
- Quá trình khử tại cathode: + 1e → Ag + 2NH3.
- Điện lượng Q = It = ne. F, F = 96 500 C/mol.
Giá trị của t là bao nhiêu? (Làm tròn kết quả đến phần mười).
Câu hỏi trong đề: 10 bài tập điện phân có lời giải !!
Quảng cáo
Trả lời:
Đáp án đúng là: C
Số mol electron: ne = 1. nAg = 0,0463 mol
Điện lượng q = ne. F = 4468 C
.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án đúng là: C
Ở cathode: Ag+ + e → Ag
Cu2+ + 2e → Cu
Ở anode: 2H2O → 4+ O2 + 4e.
Đến khi bọt khí bắt đầu thoát ra ở cathode thì mất 2 giờ, khi đó khối lượng cathode tăng thêm 4,2 g.
Sau 2h, ion kim loại a mol Ag+ và b mol Cu2+ bị điện phân hết, khối lượng cathode tăng = mAg + mCu = 108 a + 64 b = 4,2 g (1*)
Thời gian để điện phân hết a mol Ag+ và b mol Cu2+:
Từ (1*) và (2*) có a = 0,03 và b = 0,015.
Vậy nồng độ mol của Cu(NO3)2 trong dung dịch X là
Câu 2
Lời giải
Đáp án đúng là: A
Vì thành phần khí bay ra ở cực dương gồm 50% CO và 50% CO2 về thể tích.
;
x x x (mol) x 0,5x x (mol)
1,5x 2x (mol)
27. 2x= 106
x =
mC = 12.2x = 0,44.106 gam = 0,44 tấn.
Câu 3
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.