Trong công nghiệp, sulfuric acid được sản xuất từ quặng pirite sắt có thành phần chính là 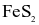 theo sơ đồ sau:
theo sơ đồ sau:
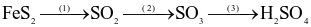
(a) Cả 3 quá trình trên đều xảy ra phản ứng oxi hóa – khử.
(b) Số oxi hóa của Fe trong 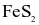 là +2.
là +2.
(c) Trong quá trình (2), 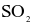 đóng vai trò là chất oxi hóa.
đóng vai trò là chất oxi hóa.
(d) Từ 1 tấn quặng chứa 60% 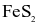 thu được 0,8 tấn
thu được 0,8 tấn 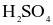 98%. (Cho hiệu suất cả quá trình là 80%).
98%. (Cho hiệu suất cả quá trình là 80%).
Câu hỏi trong đề: Bài tập ôn tập Hóa 10 Kết nối tri thức Chương 4 có đáp án !!
Quảng cáo
Trả lời:
(a) Sai. Quá trình (3) không xảy ra phản ứng oxi hóa – khử.
(b) Đúng.
(c) Sai. Trong quá trình (2), SO2 đóng vai trò là chất khử do số oxi hóa của S tăng từ +4 lên +6 sau phản ứng.
(d) Đúng. Ta có:
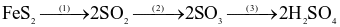
120 → 2.98 gam
0,6 → ? tấn
Khối lượng H2SO4 98% thu được là:
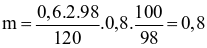 tấn.
tấn.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
(a) Sai. Trong phản ứng trên thì mỗi nguyên tử chlorine nhận1e, còn phân tử Cl2 nhận 2 electron: Cl2 +2e → 2Cl-.
(b) Sai. Số oxi hóa của Ca và Cl trước phản ứng đều là 0.
(c) Sai.
Ca → Ca2+ + 2e
0,1 0,2 mol
(d) Đúng.
Lời giải
Phương trình hóa học: Mg + 2H2SO4 → MgSO4 + SO2 + 2H2O.
(a) Sai. Hệ số cân bằng là số nguyên, tối giản của Mg là 1.
(b) Đúng. Cứ 2 phân tử H2SO4 tham gia phản ứng có 1 phân tử đóng vai trò là chất khử, một phân tử đóng vai trò là môi trường.
(c) Đúng. Mg → Mg2+ + 2e.
(d) Sai. Phản ứng chứng minh H2SO4 đặc có tính oxi hóa.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
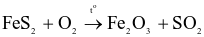
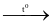 Na2S.
Na2S.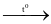 H2SO4 + 6NO2 + 2H2O.
H2SO4 + 6NO2 + 2H2O.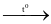 SF6.
SF6. 2Na2S + Na2S2O3 + 3H2O.
2Na2S + Na2S2O3 + 3H2O.