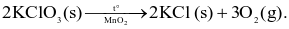Thực hiện bốn thí nghiệm sau để khảo sát các yếu tố ảnh hưởng đến tốc độ phản ứng
| Thí nghiệm | Chất phản ứng | Nhiệt độ phản ứng |
| I | Dây magnesium dư và 50 ml sulfuric acid 1M | 30oC |
| II | Dây magnesium dư và 50 ml hydrochloric acid 1M | 30oC |
| III | Bột magnesium dư và 50 ml hydrochloric acid 1M | 40oC |
| IV | Dây magnesium dư và 50 ml sulfuric acid 1M | 40oC |
(b) Thể tích khí thoát ra ở thí nghiệm I nhỏ hơn thí nghiệm IV.
(c) Thể tích khí thoát ra ở thí nghiệm I bằng 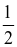 lần thí nghiệm II.
lần thí nghiệm II.
(d) Phương trình hóa học của phản ứng thí nghiệm III là Mg + 2HCl → MgCl2 + H2↑.
Câu hỏi trong đề: Bài tập ôn tập Hóa 10 Kết nối tri thức Chương 6 có đáp án !!
Quảng cáo
Trả lời:
(a) Đúng. Do thí nghiệm (II) diễn ra ở nhiệt độ thấp hơn và dây Mg có diện tích bề mặt tiếp xúc nhỏ hơn so với bột Mg.
(b) Sai. Thể tích khí thoát ra ở hai thí nghiệm là như nhau.
(c) Sai. Thể tích khí thoát ra ở thí nghiệm I gấp đôi thể tích khí thoát ra ở ống nghiệm II.
+ Ở thí nghiệm I: 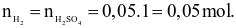
+ Ở thí nghiệm II: 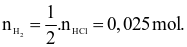
(d) Đúng.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
(a) Đúng.
(b) Sai. Chất xúc tác làm tăng tốc độ phản ứng nhưng giữ nguyên cả về chất và lượng sau khi phản ứng kết thúc (hay không bị biến đổi).
(c) Đúng.
(d) Sai. Tăng nhiệt độ phản ứng, tốc độ phản ứng diễn ra càng nhanh.
Câu 2
thể tích và bản chất các chất tham gia phản ứng.
nhiệt độ và bản chất các chất tham gia phản ứng.
tốc độ độ và bản chất các chất tham gia phản ứng.
áp suất và bản chất các chất tham gia phản ứng.
Lời giải
Đáp án đúng là: B
Hằng số tốc độ phản ứng k phụ thuộc vào nhiệt độ và bản chất các chất tham gia phản ứng.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
giảm 9 lần.
tăng 8 lần.
tăng 9 lần.
giảm 8 lần.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
Chất xúc tác.
Nhiệt độ.
Kích thước tinh thể KClO3.
Áp suất.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
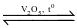 2SO3(g)
2SO3(g) MgCl2(aq)+ H2(g)
MgCl2(aq)+ H2(g)