Trong phòng thí nghiệm, một nhóm học sinh tìm hiểu ảnh hưởng của thời gian lưu giữ tới nồng độ FeSO₄ trong dung dịch. Giả thuyết của nhóm học sinh là: “Khi để lâu, nồng độ FeSO4 trong dung dịch giảm.” Nhóm học sinh chuẩn bị 250,0 mL dung dịch FeSO4 (nồng độ khoảng 0,1 M) đựng trong bình kín (dán nhãn bình là Y) và tiến hành các thí nghiệm ở hai thời điểm khác nhau như sau:
- Ngày thứ nhất:
Bước 1: Lấy 10,00 mL dung dịch trong bình Y cho vào bình tam giác rồi thêm tiếp 5 mL dung dịch H2SO4 2 M.
Bước 2: Chuẩn độ dung dịch trong bình tam giác bằng dung dịch KMnO4 2,20×10⁻2 M đến khi xuất hiện màu hồng nhạt (bền trong khoảng 20 giây) thì dừng. Ghi lại thể tích dung dịch KMnO4 đã dùng.
Lặp lại thí nghiệm chuẩn độ thêm 2 lần. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 10,70 mL. Nồng độ của Fe(II) xác định được là C1 M.
- Ngày thứ tám:
Xác định lại hàm lượng Fe(II) của dung dịch chứa trong bình Y theo các bước tương tự như ngày thứ nhất. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 9,92 mL. Nồng độ của Fe(II) xác định được là C2 M.
Nồng độ dung dịch KMnO4 như nhau trong các thí nghiệm chuẩn độ. Sự thay đổi nồng độ của Fe(II) (q%) được tính theo công thức:
\[{\rm{q\% }} = \frac{{{{\rm{C}}_{\rm{1}}} - {{\rm{C}}_2}}}{{{{\rm{C}}_1}}} \times 100{\rm{\% }}\]
Trong phòng thí nghiệm, một nhóm học sinh tìm hiểu ảnh hưởng của thời gian lưu giữ tới nồng độ FeSO₄ trong dung dịch. Giả thuyết của nhóm học sinh là: “Khi để lâu, nồng độ FeSO4 trong dung dịch giảm.” Nhóm học sinh chuẩn bị 250,0 mL dung dịch FeSO4 (nồng độ khoảng 0,1 M) đựng trong bình kín (dán nhãn bình là Y) và tiến hành các thí nghiệm ở hai thời điểm khác nhau như sau:

- Ngày thứ nhất:
Bước 1: Lấy 10,00 mL dung dịch trong bình Y cho vào bình tam giác rồi thêm tiếp 5 mL dung dịch H2SO4 2 M.
Bước 2: Chuẩn độ dung dịch trong bình tam giác bằng dung dịch KMnO4 2,20×10⁻2 M đến khi xuất hiện màu hồng nhạt (bền trong khoảng 20 giây) thì dừng. Ghi lại thể tích dung dịch KMnO4 đã dùng.
Lặp lại thí nghiệm chuẩn độ thêm 2 lần. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 10,70 mL. Nồng độ của Fe(II) xác định được là C1 M.
- Ngày thứ tám:
Xác định lại hàm lượng Fe(II) của dung dịch chứa trong bình Y theo các bước tương tự như ngày thứ nhất. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 9,92 mL. Nồng độ của Fe(II) xác định được là C2 M.
Nồng độ dung dịch KMnO4 như nhau trong các thí nghiệm chuẩn độ. Sự thay đổi nồng độ của Fe(II) (q%) được tính theo công thức:
\[{\rm{q\% }} = \frac{{{{\rm{C}}_{\rm{1}}} - {{\rm{C}}_2}}}{{{{\rm{C}}_1}}} \times 100{\rm{\% }}\]
Quảng cáo
Trả lời:
Phương trình chuẩn độ: 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Hoặc bảo toàn electron: \[{n_{FeS{O_4}}} = 5{n_{KMn{O_4}}}\]hay \[{C_{FeS{O_4}}}.{V_{FeS{O_4}}} = 5{C_{KMn{O_4}}}.{V_{KMn{O_4}}}\]
- Ngày thứ nhất: C1 = \[5.\frac{{{C_{KMn{O_4}}}.{V_{KMn{O_4}}}}}{{{V_{FeS{O_4}}}}} = 5.\frac{{2,{{2.10}^{ - 2}}.10,7}}{{10}} = 0,1177\,M.\]
- Ngày thứ tám: C1 = \[5.\frac{{{C_{KMn{O_4}}}.{V_{KMn{O_4}}}}}{{{V_{FeS{O_4}}}}} = 5.\frac{{2,{{2.10}^{ - 2}}.9,92}}{{10}} = 0,10912\,M\, \approx 0,109\,M.\]
- Sự thay đổi nồng độ của Fe(II) là:
\[{\rm{q\% }} = \frac{{{{\rm{C}}_{\rm{1}}} - {{\rm{C}}_2}}}{{{{\rm{C}}_1}}} \times 100{\rm{\% }}\] = \[\frac{{0,1177 - 0,10912}}{{0,1177}}.100\% = 7,2897\% \approx 7,3\% .\]
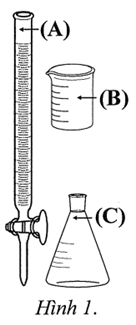
a. Sai. Phải cho vào burette (A) để xác định điểm tương đương và đo thể tích phản ứng được chính xác.
b. Sai. q = 7,3.
c. Đúng.
d. Đúng. Sau 8 ngày nồng độ giảm FeSO4 giảm 7,3%.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 500 Bài tập tổng ôn Hóa học (Form 2025) ( 38.000₫ )
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- Sổ tay lớp 12 các môn Toán, Lí, Hóa, Văn, Sử, Địa, KTPL (chương trình mới) ( 36.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án đúng là: 4
Khối lượng của 1 túi PE là: \(2.(20.30.0,02).0,95 = 22,8\,gam.\)
Khối lượng 100 000 túi PE là: 22,8. 100 000 = 2 280 000 gam = 2 280 kg.
Phương trình hóa học:
Áp dụng định luật bảo toàn khối lượng: methylene phản ứng = mPE sinh ra.
Khối lượng nguyên liệu ethylene cần dùng là:
\(m = 2280.\frac{{100}}{{95}}.\frac{{100}}{{60}} = 4000\,kg\)= 4 tấn.
Câu 2
Ở điều kiện chuẩn tính oxi hóa của ion lớn hơn nhưng yếu hơn
Trong dung dịch kim loại Cu khử được ion và ion
Sức điện động của pin Zn-Cu có giá trị là 0,42V.
Trong pin điện Zn-Cu, kim loại Zn đóng vai trò là cực âm (cathode).
Lời giải
Đáp án đúng là: A
Phát biểu B sai do: Cu không khử được ion trong dung dịch.
Phát biểu C sai do:
Phát biểu D sai do: Kim loại Cu đóng vai trò là cathode.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
Quá trình xảy ra tại cathode là
Quá trình xảy ra tại anode là
Dung dịch thu được sau phản ứng là dung dịch NaOH.
Cho mẩu giấy màu vào dung dịch sau phản ứng thấy mẩu giấy mất màu.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
