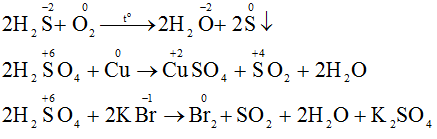Khi khí H2S và axit H2SO4 tham gia các phản ứng oxi hóa – khử, người ta có nhận xét:
- Hidro sunfua chỉ thể hiện tính khử.
- Axit sunfuric chỉ thể hiện tính oxi hóa.
a) Hãy giải thích điều nhận xét trên.
b) Đối với mỗi chất, hãy dẫn ra một phản ứng hóa học để minh họa.
Câu hỏi trong đề: Giải Hóa học 10 !!
Quảng cáo
Trả lời:
a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử và H2SO4 đặc chỉ thể hiện tính oxi hóa. Vì trong H2S số oxi hóa của S chỉ có thể tăng, trong H2SO4 số oxi hóa S chỉ có thể giảm.
Vì trong H2S số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học:
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Chọn thuốc thử Ba(OH)2
Lấy mỗi dung dịch axit một ít cho vào ống nghiệm.
- Cho từng giọt dung dịch Ba(OH)2 và các ống nghiệm chứa các axit đó:
Có kết tủa trắng là ống đựng H2SO3 và H2SO4, đó là kết tủa BaSO3 và BaSO4
⇒ Nhận biết được ống chứa HCl (không có hiện tượng gì)
- Lấy dung dịch HCl vừa nhận biết được cho vào các kết tủa:
Kết tủa tan được và có khí bay ra BaSO3, suy ngược lên ta thấy dung dịch trong ống nghiệm ban đầu là H2SO3
Kết tủa không tan trong axit là BaSO4, suy ngược lên ta thấy dung dịch trong ống nghiệm ban đầu là H2SO4.
Ba(OH)2 + H2SO3 → BaSO3 ↓ + 2H2O
Ba(OH)2 + H2SO4 → BaSO4 ↓ + 2H2O
BaSO3 + 2HCl → BaCl2 + SO2 ↑ + H2O
Lời giải
Câu trả lời đúng: C và B
- SO2 là chất oxi hóa trong phản ứng: (d) SO2 + 2H2S → 3S + 2H2O ( S+4 → S0)
- SO2 là chất khử trong các phản ứng:
(a) SO2 + 2H2O + Br2 → 2HBr + H2SO4 (S+4 → S+6)
(c) 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4 (S+4 → S+6)
(e) 2SO2 + O2 → 2SO3 (S+4 → S+6)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.