(1 điểm). Một bình gas (khí hóa lỏng) có chứa 12 kg hỗn hợp propane và butane, trong đó propane chiếm 27,5% về khối lượng. Khi đốt cháy hoàn toàn, 1 mol propane tỏa ra lượng nhiệt là 2 220 kJ và 1 mol butane tỏa ra lượng nhiệt là 2 850 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí gas của một hộ gia đình X là 10 000 kJ/ngày, hiệu suất sử dụng nhiệt là 70%, giá của bình gas trên là 400000 đồng. Số tiền hộ gia đình X cần trả cho việc mua gas trong một tháng (30 ngày) là bao nhiêu nghìn đồng?
Quảng cáo
Trả lời:
Tổng lượng nhiệt tỏa ra khi đốt cháy 12 kg khí gas là 75.2220 + 150.2850 = 594000 kJ
Vì H% = 70% lượng nhiệt thực tế đã dùng là 594000.70% = 415800 kJ
Số ngày dùng hết bình gas là ngày
41,58 ngày dùng hết bình gas trị giá 400000 đồng
1 tháng (30 ngày) tiêu tốn hết đồng = 288,6 nghìn đồng
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Hóa học 11 dùng cho cả 3 bộ sách Kết nối, Cánh diều, Chân trời sáng tạo VietJack - Sách 2025 ( 58.000₫ )
- Trọng tâm Sử, Địa, GD KTPL 11 cho cả 3 bộ Kết nối, Chân trời, Cánh diều VietJack - Sách 2025 ( 38.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án: 23
Giải thích:
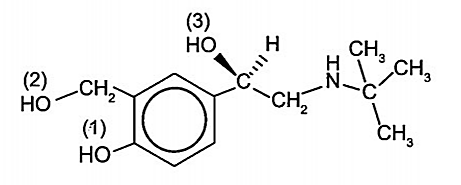
Theo định nghĩa, nhóm -OH (1) không phải nhóm chức alcohol vì nhóm -OH không liên kết trực tiếp với nguyên tử carbon no (ở đây là nguyên tử carbon của vòng benzene); nhóm -OH (2) là alcohol bậc I, nhóm -OH (3) là alcohol bậc II.
Lời giải
Đáp án: 1
Giải thích:
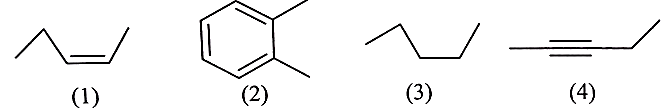
Alkene là hydrocarbon không no, mạch hở, trong phân tử có chứa 1 liên kết đôi C = C.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.