Tiến hành điện phân với điện cực trơ và màng ngăn xốp một dung dịch chứa m gam hỗn hợp CuSO4 và NaCl cho đến khi nước bắt đầu bị điện phân ở cả hai điện cực thì dừng lại. Ở anot thu được 0,896 lít khí (đkc). Dung dịch sau khi điện phân có thể hòa tan tối đa 3,2 gam CuO. Giá trị của m là:
A. 11,94
B. 9,60
C. 5,97
D. 6,40
Câu hỏi trong đề: 282 Bài tập Đại cương về kim loại cực hay có lời giải !!
Quảng cáo
Trả lời:
Chọn A.
Vì dung dịch sau phản ứng hòa tan được CuO -> Có H+
Ta có n(H+ = 2n(CuO) = 0,08 mol -> n(O2) = n(H+/4) = 0,02
Mà n(Cl2) + n(O2) = 0,04 -> n(Cl2) = 0,02 mol
Áp dụng định luật bảo toàn nguyên tố Clo -> n(NaCl) = 2n(NaCl) = 0,04 mol
Áp dụng định luật bảo toàn mol e: n(CuSO4) = 4n(O2) + 2n(Cl2))/2 = 0,06
-> m = 0,06∙160 + 0,04∙58,5 = 11,94 gam
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1
A. 2,7
B. 1,03
C. 2,95
D. 2,89
Lời giải
Chọn C
n(MgO) = 0,02; n(khí) = 0,02
Dung dịch sau điện phân có thể hòa tan MgO → có H2SO4
PTHH:
CuSO4 + 2KCl → Cu + Cl2 + K2SO4 1
x---------------------------- x mol
CuSO4 + H2O → Cu + H2SO4 + ½ O2 2
y------------------------------y ----------- y/2 mol
H2SO4 + MgO → MgSO4 + H2O
0,02 -------- 0,02 mol
Ta có hệ phương trình
1 n(khí) = x + y/2 = 0,02
2 n(H2SO4) = y = 0,02
Giải 1 2 có x = 0,01; y = 0,02
→ m(dung dịch giảm) = m(Cu) + m(Cl2) + m(O2) = 2,95 gam
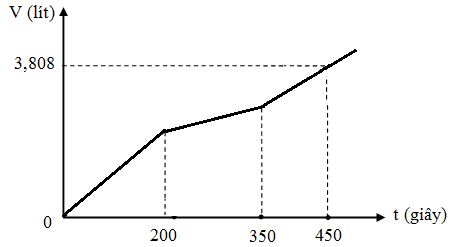
Câu 2
A. Giảm 1,88 gam
B. Tăng 1,84 gam
C. Giảm 1,84 gam
D. Tăng 0,04 gam
Lời giải
Chọn A.
Tại thời điểm t = 200 (s): chỉ có khí Cl2 (x mol) tại anot Þ ne (1) = 2x mol
Tại thời điểm t = 350 (s): có khí Cl2 (x mol) và O2 Þ ne (2) = 3,5x mol nCu = 1,75x
Tại thời điểm t = 450 (s): có khí Cl2 (x mol), O2, H2 Þ ne (3) = 4,5x mol
Tại thời điểm t = 250 (s) Þ ne = 0,2 mol Þ
Dung dịch Y có chứa H+ (0,04 mol); Cu2+ (0,04 mol)
Khi cho Y tác dụng với Al thì: mdd giảm
Câu 3
Tiến hành điện phân dung dịch X chứa hỗn hợp CuSO4 và KCl (điện cực trơ, màng ngăn xốp) với cường độ dòng điện không đổi thu được kết quả như bảng sau:
|
Thời gian điện phân (giây) |
Tổng số chất khí thoát ra ở hai điện cực |
Tổng thể tích khí thoát ra ở hai điện cực (lít) |
|
t |
1 |
1,344 |
|
2t |
2 |
2,24 |
|
3t |
x |
V |
|
4t |
3 |
5,152 |
Giả sử hiệu suất của phản ứng điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Giá trị của V là
A. 3,584
B. 3,136
C. 2,912
D. 3,36
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
A. 0,672
B. 1,120
C. 2,016
D. 2,688
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.