Cho các phát biểu sau:
(a) Anđehit vừa có tính oxi hóa vừa có tính khử.
(b) Phenol tham gia phản ứng thế brom khó hơn benzen.
(c) Anđehit tác dụng với H2 (dư) có xúc tác Ni đun nóng, thu được ancol bậc một.
(d) Natri phenolat tham gia phản ứng thế với dung dịch Br2.
(e) Dung dịch phenol trong nước làm quỳ tím hỏa đỏ.
(f) Dung dịch phenylamoni clorua làm quỳ tím hóa đỏ.
Các phát biểu sai là:
Cho các phát biểu sau:
(a) Anđehit vừa có tính oxi hóa vừa có tính khử.
(b) Phenol tham gia phản ứng thế brom khó hơn benzen.
(c) Anđehit tác dụng với H2 (dư) có xúc tác Ni đun nóng, thu được ancol bậc một.
(d) Natri phenolat tham gia phản ứng thế với dung dịch Br2.
(e) Dung dịch phenol trong nước làm quỳ tím hỏa đỏ.
(f) Dung dịch phenylamoni clorua làm quỳ tím hóa đỏ.
Các phát biểu sai là:
A. a, b, c, d.
Quảng cáo
Trả lời:
Đáp án D
Phương pháp giải:
Lý thuyết tổng hợp các chương: Ancol - Phenol; Anđehit - Axit cacboxylic.
Giải chi tiết:
(a) đúng, ví dụ thể hiện tính khử khi tác dụng với AgNO3/NH3; thể hiện tính oxi hóa khi phản ứng với H2.
(b) sai, phenol tham gia phản ứng thế brom dễ dàng hơn benzen do có sự ảnh hưởng của nhóm OH lên vòng benzen.
(c) đúng.
(d) sai, vì O trog gốc phenol của natri phenolat có đôi e của O bị Na+ chiếm mất nên natri phenolat không còn khả năng thế Br2 dễ dàng nữa (do nhóm ONa không còn là nhóm thế đẩy electron nữa).
(e) sai, phenol không làm đổi màu quỳ tím.
(f) đúng, do muối C6H5NH3Cl có MT axit.
⟹ Các phát biểu sai là (b), (d), (e).
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 500 Bài tập tổng ôn Hóa học (Form 2025) ( 38.000₫ )
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
- Tổng ôn lớp 12 môn Toán, Lí, Hóa, Văn, Anh, Sinh Sử, Địa, KTPL (Form 2025) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án D
Phương pháp giải:
Đặt nBa = x; nNa = y; nAl = z (mol).
+) nAl = 9nBa ⟹ phương trình (1)
+) Ta có nOH- = 2nBa(OH)2 + nNaOH = 2nBa + nNa (theo x, y)
Mà nAl pư = nOH- ⟹ phương trình (2)
+) Áp dụng bảo toàn e: 2nBa + nNa + 3nAl pư = 2nH2 ⟹ phương trình (3)
Giải hệ được x; y; z ⟹ giá trị của m.
Giải chi tiết:
nH2 = = 0,12 mol.
Chất rắn là Al dư ⟹ nAl dư = = 0,03 mol.
Đặt nBa = x; nNa = y; nAl = z (mol).
+) nAl = 9nBa ⟹ z = 9x (1)
+) nOH- = 2nBa(OH)2 + nNaOH = 2nBa + nNa = 2x + y (mol)
Mà nAl pư = nOH- ⟹ 2x + y = z - 0,03 (2)
+) Áp dụng bảo toàn e: 2nBa + nNa + 3nAl pư = 2nH2 ⟹ 2x + y + 3.(z - 0,03) = 2.0,12 (3)
Giải hệ (1)(2)(3) được: x = 0,01; y = 0,04; z = 0,09.
⟹ m = 0,01.137 + 0,04.23 + 0,09.27 = 4,72 gam.
Câu 2
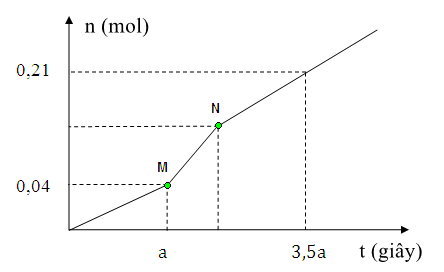
A. 11,08.
Lời giải
Đáp án C
Phương pháp giải:
Chia đồ thị ra 3 giai đoạn
Đoạn 1: chỉ có Cl2 thoát ra ở anot
Đoạn 2: Có Cl2 và H2 bên catot thoát ra
Đoạn 3: Có H2 và O2 bên anot thoát ra
Lập phương trình với số mol khí thoát ra và số mol e trao đổi sẽ tìm ra được số mol mỗi khí Cl2, H2, O2
Từ đó suy ngược lại tìm được m.
Giải chi tiết:
Tại catot: Tại anot:
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
H2O + 2e → H2 + 2OH- H2O → O2 + 4H+ + 4e
Đoạn 1: nCl2 = 0,04 mol
→ Trong a giây mỗi điện cực đã trao đổi 0,04.2 = 0,08 mol electron.
Đoạn 2: Có độ dốc lớn hơn đoạn 1 nên tốc độ thoát khí nhanh hơn → thoát Cl2 và H2
Bảo toàn electron → nCl2 = nH2 = u (mol)
Đoạn 3: Thoát H2 và O2. Đặt nO2 = v mol → nH2 = 2v mol
Ta có hệ:
nCuSO4 = nCu = nCl2 đoạn 1 = 0,04 (mol)
nNaCl = 2nCl2 tổng = 2(0,04 + 0,04) = 0,16(mol)
→ m = 0,04.160 + 0,16.58,5 = 15,76 (g)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
A. Khí H2S và khí Cl2.
B. Khí NH3 và khí HCl.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
A. 7,06.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. KOH.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.