Tiến hành hai thí nghiệm sau:
Cho m gam bột Fe (dư) vào 100 ml dung dịch Cu(NO3)2 a mol/L;
Cho m gam bột Fe (dư) vào 100 ml dung dịch AgNO3 b mol/L.
Sau khi phản ứng xảy ra hoàn toàn, khối lượng chất rắn thu được ở hai thí nghiệm bằng nhau. Mối quan hệ giữa a và b là
Tiến hành hai thí nghiệm sau:
Cho m gam bột Fe (dư) vào 100 ml dung dịch Cu(NO3)2 a mol/L;
Cho m gam bột Fe (dư) vào 100 ml dung dịch AgNO3 b mol/L.
Sau khi phản ứng xảy ra hoàn toàn, khối lượng chất rắn thu được ở hai thí nghiệm bằng nhau. Mối quan hệ giữa a và b là
A. a = b.
Quảng cáo
Trả lời:
Đáp án D
Phương pháp giải:
Cách 1: Tính theo PT ion thu gọn
TN1: Fe + Cu2+ → Fe2+ + Cu ↓
⟹ mchất rắn sau = m - mFe pư + mCu
TN2: Fe + 2Ag+ → Fe2+ + 2Ag ↓
⟹ mchất rắn sau = m - mFe pư + mAg
Do khối lượng chất rắn ở 2 thí nghiệm bằng nhau ⟹ mối liên hệ giữa a và b.
Cách 2: Tăng giảm khối lượng
Giải chi tiết:
Cách 1: Tính theo PT ion thu gọn
TN1: Fe + Cu2+ → Fe2+ + Cu ↓
0,1a ← 0,1a → 0,1a (mol)
⟹ mchất rắn sau = m - mFe pư + mCu = m - 0,1a.56 + 0,1a.64 = m + 0,8a (g)
TN2: Fe + 2Ag+ → Fe2+ + 2Ag ↓
0,05b ← 0,1b → 0,1b (mol)
⟹ mchất rắn sau = m - mFe pư + mAg = m - 0,05b.56 + 0,1b.108 = m + 8b (g)
Do khối lượng chất rắn ở 2 thí nghiệm bằng nhau ⟹ m + 0,8a = m + 8b ⟹ a = 10b.
Cách 2: Tăng giảm khối lượng
Fe → Cu
(PT) 1 1 (mol) ⟹ mtăng = 64 - 56 = 8 (g)
(ĐB) 0,1a (mol) ⟹ mtăng = 0,8a (g)
Fe → 2Ag
(PT) 1 2 (mol) ⟹ mtăng = 2.108 - 56 = 160 gam
(ĐB) 0,1b (mol) ⟹ mtăng = 8b (g)
Do khối lượng chất rắn ở 2 thí nghiệm bằng nhau ⟹ 0,8a = 8b ⟹ a = 10b.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 1200 câu hỏi lí thuyết Hóa học (Form 2025) ( 38.000₫ )
- Sổ tay Hóa học 12 (chương trình mới) ( 18.000₫ )
- Tổng ôn lớp 12 môn Toán, Lí, Hóa, Văn, Anh, Sinh Sử, Địa, KTPL (Form 2025) ( 36.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án D
Phương pháp giải:
Đặt nBa = x; nNa = y; nAl = z (mol).
+) nAl = 9nBa ⟹ phương trình (1)
+) Ta có nOH- = 2nBa(OH)2 + nNaOH = 2nBa + nNa (theo x, y)
Mà nAl pư = nOH- ⟹ phương trình (2)
+) Áp dụng bảo toàn e: 2nBa + nNa + 3nAl pư = 2nH2 ⟹ phương trình (3)
Giải hệ được x; y; z ⟹ giá trị của m.
Giải chi tiết:
nH2 = = 0,12 mol.
Chất rắn là Al dư ⟹ nAl dư = = 0,03 mol.
Đặt nBa = x; nNa = y; nAl = z (mol).
+) nAl = 9nBa ⟹ z = 9x (1)
+) nOH- = 2nBa(OH)2 + nNaOH = 2nBa + nNa = 2x + y (mol)
Mà nAl pư = nOH- ⟹ 2x + y = z - 0,03 (2)
+) Áp dụng bảo toàn e: 2nBa + nNa + 3nAl pư = 2nH2 ⟹ 2x + y + 3.(z - 0,03) = 2.0,12 (3)
Giải hệ (1)(2)(3) được: x = 0,01; y = 0,04; z = 0,09.
⟹ m = 0,01.137 + 0,04.23 + 0,09.27 = 4,72 gam.
Câu 2
A. 11,08.
Lời giải
Đáp án C
Phương pháp giải:
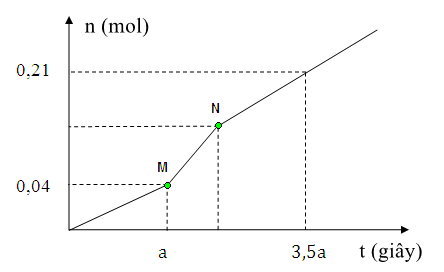
Chia đồ thị ra 3 giai đoạn
Đoạn 1: chỉ có Cl2 thoát ra ở anot
Đoạn 2: Có Cl2 và H2 bên catot thoát ra
Đoạn 3: Có H2 và O2 bên anot thoát ra
Lập phương trình với số mol khí thoát ra và số mol e trao đổi sẽ tìm ra được số mol mỗi khí Cl2, H2, O2
Từ đó suy ngược lại tìm được m.
Giải chi tiết:
Tại catot: Tại anot:
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
H2O + 2e → H2 + 2OH- H2O → O2 + 4H+ + 4e
Đoạn 1: nCl2 = 0,04 mol
→ Trong a giây mỗi điện cực đã trao đổi 0,04.2 = 0,08 mol electron.
Đoạn 2: Có độ dốc lớn hơn đoạn 1 nên tốc độ thoát khí nhanh hơn → thoát Cl2 và H2
Bảo toàn electron → nCl2 = nH2 = u (mol)
Đoạn 3: Thoát H2 và O2. Đặt nO2 = v mol → nH2 = 2v mol
Ta có hệ:
nCuSO4 = nCu = nCl2 đoạn 1 = 0,04 (mol)
nNaCl = 2nCl2 tổng = 2(0,04 + 0,04) = 0,16(mol)
→ m = 0,04.160 + 0,16.58,5 = 15,76 (g)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
A. Khí H2S và khí Cl2.
B. Khí NH3 và khí HCl.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
A. KOH.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. 7,06.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.