So sánh tính kim phi của chlorine và iodine
Chuẩn bị: Hình ảnh hoặc video phản ứng của nước của chlorine với dung dịch potassium iodide (∗).
Tiến hành: Quan sát hình ảnh hoặc xem video phản ứng của nước chlorine với dung dịch potassium iodide.
Câu hỏi: So sánh tính phi kim của chlorine và iodine.
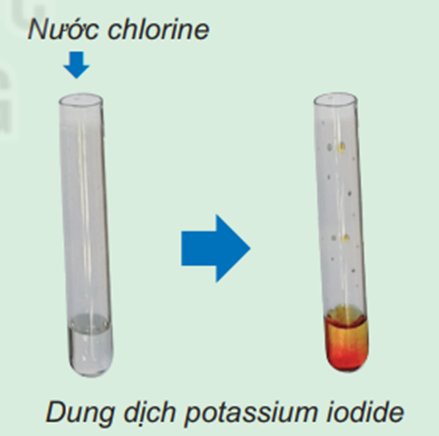
Hình 6.5. Phản ứng của nước chlorine với dung dịch potassium iodide
So sánh tính kim phi của chlorine và iodine
Chuẩn bị: Hình ảnh hoặc video phản ứng của nước của chlorine với dung dịch potassium iodide (∗).
Tiến hành: Quan sát hình ảnh hoặc xem video phản ứng của nước chlorine với dung dịch potassium iodide.
Câu hỏi: So sánh tính phi kim của chlorine và iodine.

Hình 6.5. Phản ứng của nước chlorine với dung dịch potassium iodide
Quảng cáo
Trả lời:
Khi cho nước chlorine vào dung dịch potassium iodide, sau một thời gian thấy dung dịch màu vàng nâu.
⇒ Chlorine có tính phi kim mạnh hơn iodine.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
a) Các nguyên tố hóa học trong almelec là Al, Mg, Si.
Ba nguyên tố này đều thuộc chu kì 3, theo thứ tự điện tích tăng dần Mg (Z = 12), Al (Z = 13), Si (Z = 14) thì bán kính nguyên tử giảm từ Mg > Al > Si vì lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng.
⇒ Thứ tự tăng dần về bán kính nguyên tử là Si < Al < Mg.
b) Ba nguyên tố này đều thuộc chu kì 3, theo thứ tự điện tích tăng dần Mg (Z = 12), Al (Z = 13), Si (Z = 14) thì độ âm điện tăng từ Mg < Al < Si vì khi số electron lớp ngoài cùng tăng, điện tích hạt nhân tăng dẫn đến lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng.
⇒ Thứ tự độ âm điện giảm dần là Si > Al > Mg.
Lời giải
Đáp án B
- Trong một nhóm, tính phi kim giảm dần theo chiều tăng của điện tích hạt nhân.
F (Z = 9) và Cl (Z = 17) đều thuộc nhóm VIIA nên tính phi kim của F > Cl.
O (Z = 8) và Se (Z = 34) đều thuộc nhóm VIA nên tính phi kim của O > Se.
- Trong một chu kì, tính phi kim tăng dần theo chiều tăng của điện tích hạt nhân.
O (Z = 8) và F (Z =9) đều thuộc chu kì 2 nên tính phi kim của F > O.
Lưu ý: F là phi kim mạnh nhất.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.