Phản ứng thế của một số muối halide
Chuẩn bị: 3 ống nghiệm, dung dịch NaBr, dung dịch NaI, nước Cl2, nước Br2 loãng.
Tiến hành:
- Lấy khoảng 2 mL dung dịch NaBr vào ống nghiệm (1), 2 mL dung dịch NaI vào mỗi ống nghiệm (2) và (3).
- Thêm vào ống nghiệm (1) và (2) vài giọt nước Cl2, thêm vào ống (3) vài giọt nước Br2, lắc đều các ống nghiệm.
Lưu ý: Cẩn thận không để nước Cl2, nước Br2 giây ra tay, quần áo.
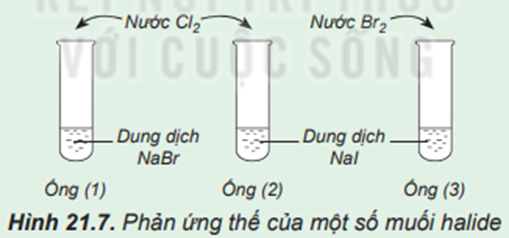
Quan sát sự thay đổi màu của dung dịch trong các ống nghiệm và trả lời câu hỏi:
1. Nhận xét sự thay đổi màu của dung dịch trong các ống nghiệm.
2. So sánh tính oxi hoá của Cl2, Br2, I2.
3. Hãy chọn một thuốc thử để chứng tỏ có sự tạo thành I2 khi cho nước chlorine (hoặc nước bromine) tác dụng với dung dịch sodium iodide.
Phản ứng thế của một số muối halide
Chuẩn bị: 3 ống nghiệm, dung dịch NaBr, dung dịch NaI, nước Cl2, nước Br2 loãng.
Tiến hành:
- Lấy khoảng 2 mL dung dịch NaBr vào ống nghiệm (1), 2 mL dung dịch NaI vào mỗi ống nghiệm (2) và (3).
- Thêm vào ống nghiệm (1) và (2) vài giọt nước Cl2, thêm vào ống (3) vài giọt nước Br2, lắc đều các ống nghiệm.
Lưu ý: Cẩn thận không để nước Cl2, nước Br2 giây ra tay, quần áo.

Quan sát sự thay đổi màu của dung dịch trong các ống nghiệm và trả lời câu hỏi:
1. Nhận xét sự thay đổi màu của dung dịch trong các ống nghiệm.
2. So sánh tính oxi hoá của Cl2, Br2, I2.
3. Hãy chọn một thuốc thử để chứng tỏ có sự tạo thành I2 khi cho nước chlorine (hoặc nước bromine) tác dụng với dung dịch sodium iodide.
Câu hỏi trong đề: Bài tập Nhóm halogen có đáp án !!
Quảng cáo
Trả lời:
1. Ống nghiệm (1): dung dịch chuyển sang màu vàng.
Ống nghiệm (2): dung dịch có màu vàng và có chất rắn màu đen tím.
Ống nghiệm (3): dung dịch màu vàng nhạt dần và có chất rắn màu đen tím.
2. Tính oxi hóa của Clo mạnh hơn Brom nên Clo có thể đẩy ion Br– ra khỏi dung dịch muối.
Tính oxi hóa của Brom mạnh hơn Iot nên Brom có thể đẩy ion I– ra khỏi dung dịch muối.
⇒ Tính oxi hóa của Cl2 > Br2 > I2.
3. Để chứng tỏ có sự tạo thành I2 khi cho nước chlorine (hoặc nước bromine) tác dụng với dung dịch sodium iodide ta có thể dùng thuốc thử là hồ tinh bột vì I2 tạo màu xanh đặc trưng với hồ tinh bột.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đổi 80 000m3 = 80 000 000 L = 8.107 L
5 mg Cl2 được dùng để khử trùng 1 L nước sinh hoạt.
x mg Cl2 được dùng để khử trùng 8.107 L nước sinh hoạt.
⇒ x = mg = 400 kg
Lời giải
Phương trình minh họa tính oxi hóa giảm dần trong dãy Cl2, Br2, I2 là:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.