Sử dụng kết quả tính tối ưu hóa cấu trúc để thấy được cấu trúc hình học của phân tử H2O.
Sử dụng kết quả tính tối ưu hóa cấu trúc để thấy được cấu trúc hình học của phân tử H2O.
Quảng cáo
Trả lời:
Trả lời:
Cách tiến hành:
Bước 1. Mở phần mềm Avogadro. Chọn lệnh File ⟶ New ⟶ Display Settings (Cài đặt hiển thị) ⟶ Display Types (Kiểu hiển thị) ⟶ Ball and Stick (Quả cầu và que nối). Sau đó chọn lệnh Build ⟶ Cartesian Editor (Hình 11.1a), một cửa sổ xuất hiện cho phép dán toạ độ Descartes của phân tử để hiển thị cấu trúc.
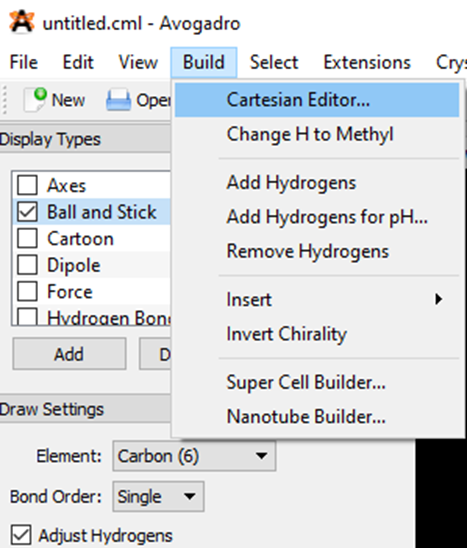
Bước 2. Mỡ file kết quả tính "H2O_AM1.out" thu được ở trên, đi đến đoạn văn bản sau:
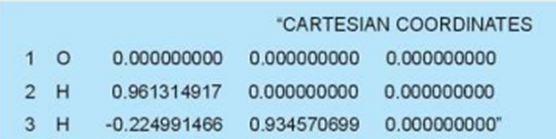
Bước 3. Copy các dòng toạ độ Descartes này dán sang vị trí mô tả toạ độ Descartes tương ứng ở cửa sổ Cartesian Editor của giao diện Avogadro. Nháy chuột vào Apply rồi nháy vào giao diện Avogadro, hình ảnh cấu trúc hình học phân tử H2O xuất hiện trên màn hình Avogadro
Các bước hiển thị các tham số cấu trúc:
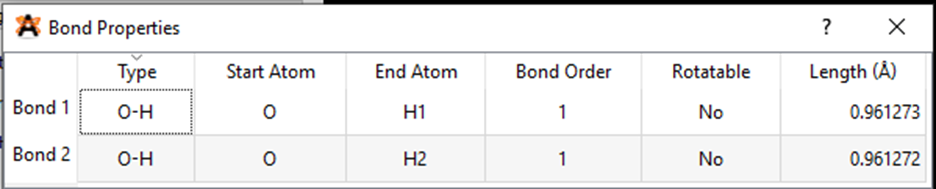
• Hiển thị độ dài các liên kết
Chọn lệnh View→ Properties ⟶ Bond Properties.
Một bảng số liệu độ dài của các liên kết xuất hiện ở màn hình
• Hiển thị góc các liên kết
Chọn lệnh View ⟶ Properties ⟶ Angle Properties.
Một bảng số liệu các góc liên kết xuất hiện ở màn hình, nói tiếp phía dưới của độ dài liên kết.
Lưu ý: Các giá trị kết quả mà em thu được có thể có sai khác so với kết quả trên.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Trả lời:
Từ bảng kết quả ở hoạt động 4, chúng ta thấy:
- Độ dài liên kết O – H là 0,96127244
- Góc liên kết là 103,5266356 o
⇒ Các giá trị này khá gần đúng so với giá trị thực nghiệm.
Lời giải
Trả lời:
Từ kết quả ta thấy:
- Độ dài liên kết giảm dần từ H2O < NH3 < CH4 và điều này phù hợp với định luật tuần hoàn.
Giải thích:
Các nguyên tử O, N, C đều liên kết với H bằng cách góp chung electron, mà độ âm điện tăng dần từ C, N, O và bán kính nguyên tử giảm dần từ C, N, O nên độ dài liên kết CH4 > NH3 > H2O.
- Góc liên kết tăng dần theo thứ tự: H2O, NH3, CH4.
Giải thích:
+ Do trong 3 phân tử H2O, NH3, CH4, nguyên tử trung tâm đều lai hóa sp3, phân tử CH4 có cấu tạo tứ diện, góc HCH = 109o28’, còn trong phân tử H2O và NH3 góc bị ép lại nhỏ hơn 109o28’ do sự đẩy nhau giữa 2 cặp electron không liên kết lớn nhất, sau đó đến sự đẩy nhau giữa electron không liên kết với electron liên kết, cuối cùng là sự đẩy giữa hai mây electron liên kết là yếu nhất.
+ Trong H2O, O còn 2 cặp electron chưa tham gia liên kết còn trong NH3, N có 1 cặp electron chưa liên kết nên góc liên kết của H2O nhỏ hơn NH3.
- Năng lượng phân tử âm dần theo thứ tự: CH4, NH3, H2O
Năng lượng tổng càng âm phân tử càng bền. Phù hợp với sự biến đổi độ âm điện. Độ âm điện tăng dần theo thứ tự C, N, O nên lực hút giữa các nguyên tử đó với H tăng dầnLời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
