Nêu mối quan hệ về năng lượng của electron trên các orbital, các phân lớp, các lớp electron.
Quảng cáo
Trả lời:
Mối quan hệ về năng lượng:
- Những electron ở lớp gần hạt nhân bị hút mạnh hơn về phía hạt nhân, vì thế có năng lượng thấp hơn so với những electron ở lớp xa hạt nhân. Mức năng lượng tăng dần theo lớp electron: K < L < M < N < O < …
- Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau. Mức năng lượng tăng dần theo AO: s < p < d < f.
- Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
+) Z = 9 (1s22s22p5): nguyên tử có 7 electron hóa trị, dễ thu electron, là phi kim.
Cấu hình electron theo ô orbital:
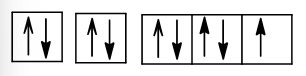
+) Z = 14 (1s22s22p63s23p2): nguyên tử có 4 electron hóa trị nên có thể thu electron hoặc nhường electron, là phi kim.
Cấu hình electron theo ô orbital:
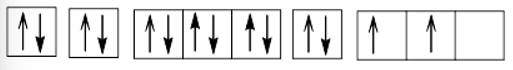
+) Z = 21 (1s22s22p63s23p63d14s2): nguyên tử có 3 electron hóa trị, dễ nhường electron, là kim loại.

Lời giải
a) Coi tổng số hạt trong [M] là x và [X] là y
Theo bài ra ta có: 4x + 3y = 214 (I)
và 4x – 3y = 106 (II)
Giải hệ (I) và (II), ta được: x = 40 và y = 18.
Số p = số e nên ta có:
2pM + nM = 40 với và pM < 20
⇒ pM = 13 và nM = 14
⇒ M là 13Al.
2pX + nX = 18 với và pX < 9
⇒ pX = 6 và nX = 6
⇒ X là 6C.
Công thức hóa học của A là Al4C3.
b) Cấu hình electron: 13Al (1s22s22p63s23p1) và 6C (1s22s22p2)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.