Câu hỏi trong đề: Giải SBT Hóa học 10 Bài 10. Quy tắc octet có đáp án !!
Quảng cáo
Trả lời:
Đáp án:
A. H2O
Quy tắc octet không đúng với trường hợp NO2
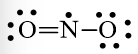
Nguyên tử N chỉ có 7 electron lớp ngoài cùng.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
- Nguyên tử O có 6 electron lớp ngoài cùng. Để tạo thành phân tử O2, mỗi nguyên tử O góp chung 2 electron tạo thành cặp electron dùng chung. Khi đó mỗi nguyên tử O đều có 8 electron lớp ngoài cùng, thỏa mãn quy tắc octet.
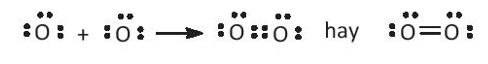
- Nguyên tử C có 4 electron lớp ngoài cùng, nguyên tử O có 6 electron lớp ngoài cùng. Để tạo thành phân tử CO2, nguyên tử C góp chung với mỗi O 2 electron. Khi đó C và O đều thỏa mãn quy tắc octet.

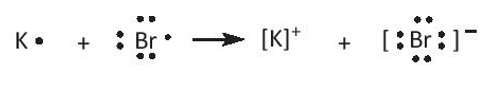
- Nguyên tử K có 1 electron lớp ngoài cùng, nguyên tử Br có 7 electron lớp ngoài cùng. Để tạo thành phân tử KBr, nguyên tử K nhường 1 electron tạo ion K+, nguyên tử Br nhận 1 electron từ nguyên tử K tạo ion Br-. Hai ion trái dấu hút nhau để tạo thành phân tử KBr.
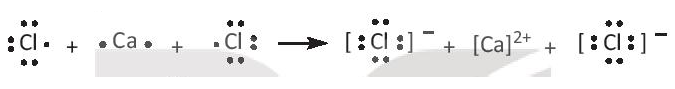
- Nguyên tử Ca có 2 electron lớp ngoài cùng, nguyên tử Cl có 7 electron lớp ngoài cùng. Để tạo thành phân tử CaCl2, nguyên tử Ca nhường 2 electron để tạo thành ion Ca2+, mỗi nguyên tử Cl nhận 1 electron từ nguyên tử Ca để tạo thành ion Cl-. Các ion trái dấu hút nhau tạo thành phân tử CaCl2
Lời giải
a) A thuộc nhóm IVA và D thuộc nhóm VIA ⇒ số oxi hóa cao nhất của A trong X là +4 còn số oxi hóa của D trong X là -2.
Công thức phân tử X có dạng AD2. Ta có: A + 2D = 76.
⇒ Nguyên tử khối trung bình của A, D là: = 25,33
⇒ A và D thuộc chu kì 2, 3 ⇒ Có các cặp nguyên tố sau:
C = 12 và O = 16; C = 12 và S = 32; Si = 28 và O = 16; Si = 28 và S = 32.
C = 12 và S = 32 thỏa mãn A + 2D = 76 ⇒ Công thức X: CS2.
b) Đề xuất công thức Lewis:
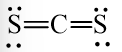
Công thức cấu tạo:
![]()
CS2 có cấu trúc thẳng giống CO2.
Các nguyên tử C và S đều có 8 electron lớp ngoài cùng theo quy tắc octet.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.