Cho dung dịch CuSO4 có khối lượng riêng D = 1,206 gam/ml (dung dịch X). Cô cạn 414,59 ml X thu được tối đa 140,625 gam tinh thể CuSO4.5H2O. Tính nồng độ phần trăm và nồng độ mol của X.
Cho dung dịch CuSO4 có khối lượng riêng D = 1,206 gam/ml (dung dịch X). Cô cạn 414,59 ml X thu được tối đa 140,625 gam tinh thể CuSO4.5H2O. Tính nồng độ phần trăm và nồng độ mol của X.
Quảng cáo
Trả lời:
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
c. Cho mẩu Zn dư vào dung dịch Fe2(SO4)3
Hiện tượng: dung dịch màu vàng chuyển dần thành trong suốt không màu, đồng thời có kim loại màu xám trắng bám lên thanh kẽm.
Phương trình hóa học:
Zn + Fe2(SO4)3 → ZnSO4 + 2FeSO4
Zn + FeSO4 → Fe↓ + ZnSO4
Lời giải
Hướng dẫn giải:
MI = 1,1094.64 = 71 → I là khí Cl2
Trung hòa dung dịch chứa 2,24 gam (L) cần dd chứa 0,02 mol H2SO4:
Vậy a = 1; X = 39 thỏa mãn.
Vậy X là K suy ra L là KOH
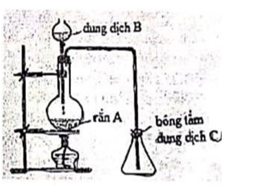
Phương trình hóa học minh họa sơ đồ :
2KMnO4 K2MnO4 + MnO2 + O2
MnO2 + 4HCl(đ) MnCl2 + 2H2O + Cl2
2KMnO4 + 16HCl(đ) 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2KCl + 2H2O 2KOH + Cl2 + H2
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.