Viết phương trình hoá học xảy ra khi cho dung dịch (NH4)2CO3 lần lượt tác dụng với lượng dư các dung dịch: HCl, Ba(OH)2.
Viết phương trình hoá học xảy ra khi cho dung dịch (NH4)2CO3 lần lượt tác dụng với lượng dư các dung dịch: HCl, Ba(OH)2.
Quảng cáo
Trả lời:
Các phản ứng xảy ra:
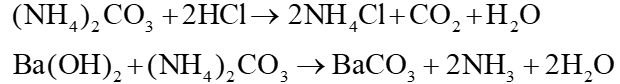
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Hóa học 11 dùng cho cả 3 bộ sách Kết nối, Cánh diều, Chân trời sáng tạo VietJack - Sách 2025 ( 58.000₫ )
- Trọng tâm Sử, Địa, GD KTPL 11 cho cả 3 bộ Kết nối, Chân trời, Cánh diều VietJack - Sách 2025 ( 38.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án đúng là: B
Giả sử có 1 mol N2 và 4 mol H2.
Phương trình hoá học: N2 + 3H2 ⇌ 2NH3
Ban đầu: 1 4 0 mol
Phản ứng: x 3x 2x mol
Sau phản ứng: (1 – x) (4 – 3x) 2x mol
Tổng số mol khí sau phản ứng: nsau = (1 – x) + (4 – 3x) + 2x = 5 – 2x (mol).
Áp dụng định luật bảo toàn khối lượng có:
mtrước = msau ⇔ 28.1 + 2.4 = (5 – 2x).4.2 Þ x = 0,25.
Giả sử H = 100% thì N2 hết, do đó hiệu xuất phản ứng tính theo N2.
Ta có: H = = 25%.
Lời giải
Đáp án đúng là: D
Giả sử ban đầu có x mol N2 và y mol H2.
Ta có:
Giả sử có 1 mol N2 và 4 mol H2. Vậy số mol ban đầu là 5 mol.
Phương trình hoá học: N2 + 3H2 ⇌ 2NH3
Ban đầu: 1 4 0 mol
Phản ứng: x 3x 2x mol
Sau phản ứng: (1 – x) (4 – 3x) 2x mol
Tổng số mol khí sau phản ứng: nsau = (1 – x) + (4 – 3x) + 2x = 5 – 2x (mol).
Số mol Y giảm 8% so với ban đầu
Giả sử H = 100% thì N2 hết, do đó hiệu xuất phản ứng tính theo N2.
Ta có: H = = 20%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.