Phản ứng oxi hoá – khử luôn kèm theo sự chuyển electron từ chất khử sang chất oxi hoá. Nếu các quá trình oxi hoá, quá trình khử xảy ra trên hai điện cực và electron được truyền từ chất khử sang chất oxi hoá qua dây dẫn thì năng lượng của phản ứng hoá học sẽ chuyển thành năng lượng điện.
Xét phản ứng oxi hoá – khử:
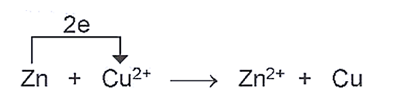
Phản ứng hoá học trên xảy ra trong hai thí nghiệm sau:
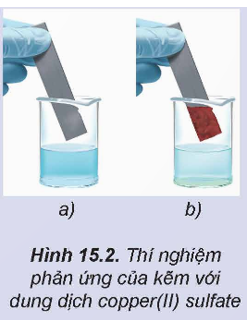
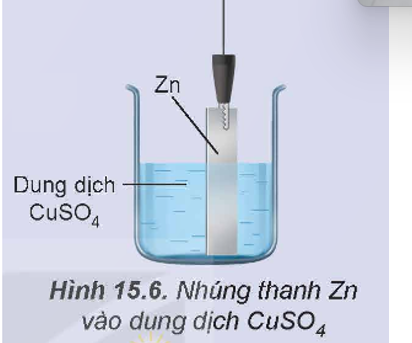
Thí nghiệm 1: Cho Zn tiếp xúc trực tiếp với ion Cu2+ bằng cách nhúng thanh Zn vào dung dịch CuSO4 (Hình 15.6), thấy xuất hiện kim loại đồng màu đỏ bám trên bề mặt thanh kẽm.
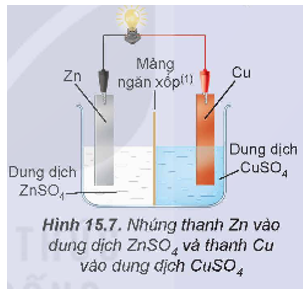
Thí nghiệm 2: Lắp hệ điện hoá gồm hai điện cực Zn2+/Zn và Cu2+/Cu như Hình 15.7, thấy bóng đèn sáng.
Thực hiện các yêu cầu sau:
1. Viết quá trình oxi hoá, quá trình khử trong mỗi thí nghiệm.
2. Trong thí nghiệm nào thì quá trình oxi hoá và quá trình khử cùng xảy ra trên bề mặt của một thanh kim loại?
3. Tại sao trong thí nghiệm 2 bóng đèn lại sáng?
Phản ứng oxi hoá – khử luôn kèm theo sự chuyển electron từ chất khử sang chất oxi hoá. Nếu các quá trình oxi hoá, quá trình khử xảy ra trên hai điện cực và electron được truyền từ chất khử sang chất oxi hoá qua dây dẫn thì năng lượng của phản ứng hoá học sẽ chuyển thành năng lượng điện.
Xét phản ứng oxi hoá – khử:
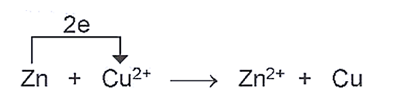
Phản ứng hoá học trên xảy ra trong hai thí nghiệm sau:
Thí nghiệm 1: Cho Zn tiếp xúc trực tiếp với ion Cu2+ bằng cách nhúng thanh Zn vào dung dịch CuSO4 (Hình 15.6), thấy xuất hiện kim loại đồng màu đỏ bám trên bề mặt thanh kẽm.

Thí nghiệm 2: Lắp hệ điện hoá gồm hai điện cực Zn2+/Zn và Cu2+/Cu như Hình 15.7, thấy bóng đèn sáng.

Thực hiện các yêu cầu sau:
1. Viết quá trình oxi hoá, quá trình khử trong mỗi thí nghiệm.
2. Trong thí nghiệm nào thì quá trình oxi hoá và quá trình khử cùng xảy ra trên bề mặt của một thanh kim loại?
3. Tại sao trong thí nghiệm 2 bóng đèn lại sáng?
Quảng cáo
Trả lời:
1. Thí nghiệm 1:
Quá trình oxi hoá: Zn → Zn2+ + 2e;
Quá trình khử: Cu2+ + 2e → Cu.
Thí nghiệm 2:
Quá trình oxi hoá: Zn → Zn2+ + 2e;
Quá trình khử: Cu2+ + 2e → Cu.
2. Trong thí nghiệm 1, quá trình oxi hoá và quá trình khử cùng xảy ra trên bề mặt của một thanh kim loại.
3. Trong thí nghiệm 2, bóng đèn lại sáng vì các quá trình oxi hoá, quá trình khử xảy ra trên hai điện cực và electron được truyền từ chất khử sang chất oxi hoá qua dây dẫn thì năng lượng của phản ứng hoá học sẽ chuyển thành năng lượng điện.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- Sổ tay lớp 12 các môn Toán, Lí, Hóa, Văn, Sử, Địa, KTPL (chương trình mới) ( 36.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
a) Phương trình hoá học của phản ứng ở dạng ion thu gọn:
Fe + 2H+ → Fe2+ + H2
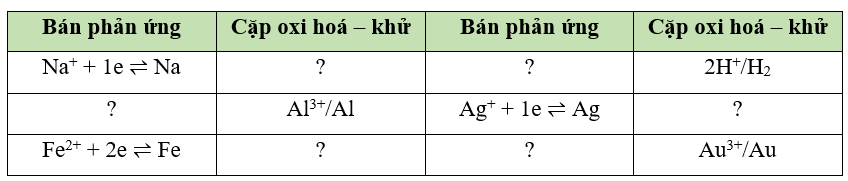
b) Các cặp oxi hoá – khử trong phản ứng trên: Fe2+/Fe, 2H+/H2.
Lời giải
Sắp xếp các cặp oxi hoá – khử trên theo chiều giảm dần tính khử của dạng khử:
Na+/Na; Mg2+/Mg; Al3+/Al; Zn2+/Zn; Fe2+/Fe; 2H+/H2; Cu2+/Cu; Ag+/Ag.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.