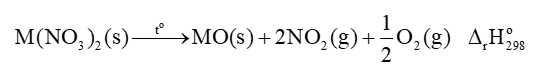Một số đại lượng đặc trưng của các nguyên tố nhóm IIA được trình bày trong Bảng 25.1.
Thực hiện các yêu cầu sau:
1. Nhận xét xu hướng biến đổi bán kính nguyên tử của nguyên tố nhóm IIA.
2. Dựa vào bán kính nguyên tử, điện tích hạt nhân, dự đoán xu hướng biến đổi tính khử từ Be đến Ba.
3. Dự đoán số oxi hoá đặc trưng của nguyên tử của nguyên tố nhóm IIA. Giải thích.
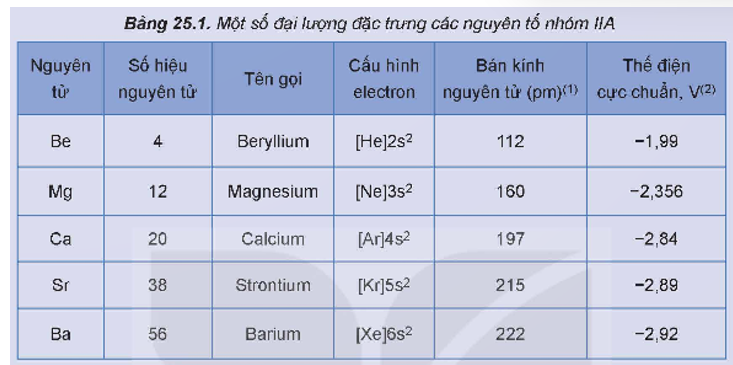
Một số đại lượng đặc trưng của các nguyên tố nhóm IIA được trình bày trong Bảng 25.1.

Thực hiện các yêu cầu sau:
1. Nhận xét xu hướng biến đổi bán kính nguyên tử của nguyên tố nhóm IIA.
2. Dựa vào bán kính nguyên tử, điện tích hạt nhân, dự đoán xu hướng biến đổi tính khử từ Be đến Ba.
3. Dự đoán số oxi hoá đặc trưng của nguyên tử của nguyên tố nhóm IIA. Giải thích.
Quảng cáo
Trả lời:
1. Xu hướng biến đổi bán kính nguyên tử của nguyên tố nhóm IIA: Theo chiều từ trên xuống dưới (chiều tăng dần của điện tích hạt nhân) bán kính nguyên tử tăng dần.
2. Dự đoán xu hướng biến đổi tính khử từ Be đến Ba: tính khử tăng dần.
3. Dự đoán số oxi hoá đặc trưng của nguyên tử của nguyên tố nhóm IIA trong hợp chất là +2. Do nguyên tử của nguyên tố nhóm IIA có 2 electron ở lớp ngoài cùng, dễ nhường 2 electron này để đạt cấu hình electron bền vững của khí hiếm.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- Sổ tay lớp 12 các môn Toán, Lí, Hóa, Văn, Sử, Địa, KTPL (chương trình mới) ( 36.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội, TP Hồ Chí Minh (2 cuốn) ( 150.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
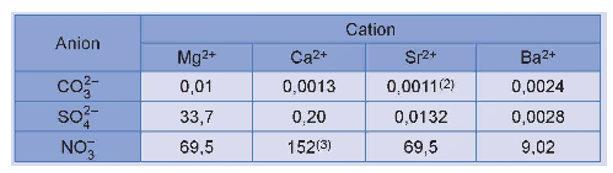
Nhận xét:
+ Các muối nitrate đều dễ tan trong nước.
+ Các muối carbonate: MgCO3, CaCO3, SrCO3, BaCO3 đều không tan trong nước.
+ Muối MgSO4 tan, muối CaSO4 và SrSO4 ít tan, muối BaSO4 không tan trong nước.
Chú ý:
Độ tan của chất: S (g/100g H2O ở nhiệt độ thường).
+ Chất dễ tan: S > 1,0.
+ Chất ít tan: 0,01 < S ≤ 1.
+ Chất không tan: S ≤ 0,01.
Lời giải
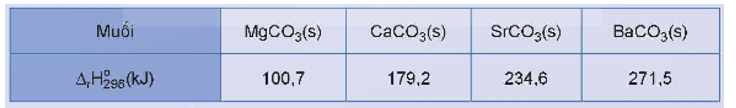
1. Đi từ Mg(OH)2 đến Ba(OH)2 độ tan trong nước của các hydroxide nhóm IIA tăng dần.
2. Dựa vào độ tan trong nước của các hydroxide dự đoán mức độ phản ứng với nước của kim loại nhóm IIA (từ Mg đến Ba) tăng dần.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.