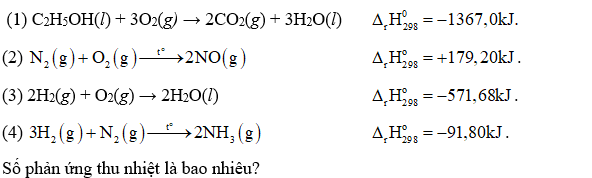Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện...) và giúp ngăn cản sự phát triển của một số vi khuẩn và nấm gây hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25°C, phản ứng giữa sulfur với oxygen xảy ra theo phương trình hóa học: S (s) + O2(g) → SO2(g) và tỏa ra một lượng nhiệt là 296,9kJ.
a). Nhiệt tạo thành chuẩn của sulfur (s) và oxygen (g) đều bằng 0 kJ.mol-1;
Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện...) và giúp ngăn cản sự phát triển của một số vi khuẩn và nấm gây hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25°C, phản ứng giữa sulfur với oxygen xảy ra theo phương trình hóa học: S (s) + O2(g) → SO2(g) và tỏa ra một lượng nhiệt là 296,9kJ.
a). Nhiệt tạo thành chuẩn của sulfur (s) và oxygen (g) đều bằng 0 kJ.mol-1;
Quảng cáo
Trả lời:
a. Đúng. Nhiệt tạo thành chuẩn của các đơn chất ở trạng thái bền nhất bằng 0.
Câu hỏi cùng đoạn
Câu 2:
b). Nhiệt tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ.mol-1.
b). Nhiệt tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ.mol-1.
b. Đúng. Nhiệt tạo thành chuẩn của 1 chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở trạng thái bền nhất, ở điều kiện chuẩn.
Câu 3:
c). Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ.
c). Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ.
Sai. Biến thiên enthalpy chuẩn của phản ứng là -296,9 kJ.mol-1.
Câu 4:
d). 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45kJ năng lượng dưới dạng nhiệt.
d). 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45kJ năng lượng dưới dạng nhiệt.
Đúng. Cứ 1 mol sulfur tác dụng hết với oxygen giải phóng 296,9kJ năng lượng dưới dạng nhiệt.
Nên 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45kJ năng lượng dưới dạng nhiệt.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Lời giải:
Đáp án đúng là: -111
Giải thích:
⇒ - 283 = - 393,5.1 –
⇒ . Làm tròn -111 kJ.
Lời giải
Đúng. Trong KMnO4, số oxi hóa của K là +1, số oxi hóa của O là -2. Gọi số oxi hóa của Mn là x ⇒ 1 + x + (-2).4 = 0 ⇒ x = +7.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.