Trong công nghiệp, ammonia được tổng hợp theo quá trình Haber (còn được gọi là quá trình Haber – Bosch). Phương trình hóa học của phản ứng diễn ra như sau:
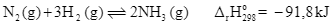
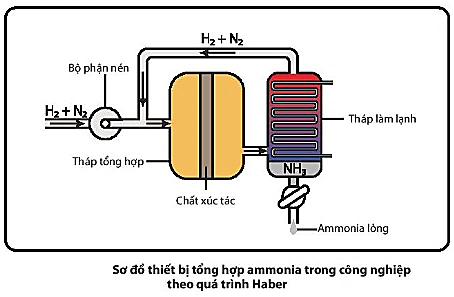
Quá trình Haber được thực hiện như sau:
- Hỗn hợp nitrogen và hydrogen (tỉ lệ mol 1 : 3) được nén ở áp suất cao và đưa vào tháp tổng hợp ammonia trong điều kiện nhiệt độ, áp suất và chất xúc tác thích hợp.
- Hỗn hợp khí đi ra từ tháp tổng hợp gồm 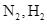 và
và 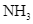 được dẫn đến tháp làm lạnh. Ở đây,
được dẫn đến tháp làm lạnh. Ở đây, 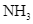 hóa lỏng và được tách riêng, còn hỗn hợp
hóa lỏng và được tách riêng, còn hỗn hợp 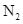 và
và 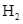 chưa phản ứng được đưa trở lại tháp tổng hợp.
chưa phản ứng được đưa trở lại tháp tổng hợp.
Trong công nghiệp, ammonia được tổng hợp theo quá trình Haber (còn được gọi là quá trình Haber – Bosch). Phương trình hóa học của phản ứng diễn ra như sau:
![]()

Quá trình Haber được thực hiện như sau:
- Hỗn hợp nitrogen và hydrogen (tỉ lệ mol 1 : 3) được nén ở áp suất cao và đưa vào tháp tổng hợp ammonia trong điều kiện nhiệt độ, áp suất và chất xúc tác thích hợp.
- Hỗn hợp khí đi ra từ tháp tổng hợp gồm ![]() và
và ![]() được dẫn đến tháp làm lạnh. Ở đây,
được dẫn đến tháp làm lạnh. Ở đây, ![]() hóa lỏng và được tách riêng, còn hỗn hợp
hóa lỏng và được tách riêng, còn hỗn hợp ![]() và
và ![]() chưa phản ứng được đưa trở lại tháp tổng hợp.
chưa phản ứng được đưa trở lại tháp tổng hợp.
Quảng cáo
Trả lời:
![]()
Số oxi hóa của hydrogen tăng từ 0 lên +1 sau phản ứng. Do đó, vai trò của hydrogen trong phản ứng tổng hợp ammonia là chất khử. Chọn A.
Câu hỏi cùng đoạn
Câu 2:
Tốc độ của phản ứng tổng hợp ammonia tuân theo định luật tác dụng khối lượng. Khi tăng nồng độ của hydrogen lên 2 lần, tốc độ phản ứng thuận:
Áp dụng định luật tác dụng khối lượng: ![]()
Khi tăng nồng độ của hydrogen lên 2 lần: 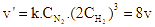
Hay tốc độ của phản ứng thuận tăng 8 lần. Chọn C.
Câu 3:
Thực hiện phản ứng tổng hợp ammonia từ 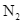 và
và 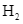 với hiệu suất h%, thu được hỗn hợp X chứa 10%
với hiệu suất h%, thu được hỗn hợp X chứa 10% 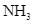 (về thể tích). Cho X tác dụng với CuO dư, nung nóng. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp Y (gồm khí và hơi) và hỗn hợp rắn Z có khối lượng giảm đi so với khối lượng CuO ban đầu là 12,8 gam. Làm lạnh Y, còn 7,437 lít khí (đkc) không bị ngưng tụ. Giá trị của h là
(về thể tích). Cho X tác dụng với CuO dư, nung nóng. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp Y (gồm khí và hơi) và hỗn hợp rắn Z có khối lượng giảm đi so với khối lượng CuO ban đầu là 12,8 gam. Làm lạnh Y, còn 7,437 lít khí (đkc) không bị ngưng tụ. Giá trị của h là
![]() →
→ 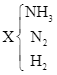
![]()
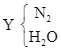
![]() N2.
N2.
Sau khi ngưng tụ còn lại khí N2 ⟹ ![]() = 0,3 mol =
= 0,3 mol = ![]() (ban đầu).
(ban đầu).
N2 + 3H2 ⇌ 2NH3
3CuO + 2NH3 ![]() 3Cu + N2 + 3H2O
3Cu + N2 + 3H2O
CuO + H2 ![]() Cu + H2O
Cu + H2O
mchất rắn giảm = mO phản ứng = 12,8 gam ⟹ nO phản ứng = 0,8 mol.
Bảo toàn electron toàn bộ quá trình: ![]() (ban đầu) = 2nO phản ứng ⟹
(ban đầu) = 2nO phản ứng ⟹ ![]() (ban đầu) = 0,8 (mol).
(ban đầu) = 0,8 (mol).
Ta thấy: ![]() ⟹ Hiệu suất tính theo H2.
⟹ Hiệu suất tính theo H2.
N2 + 3H2 ⇌ 2NH3
Ban đầu: 0,3 0,8 (mol)
Phản ứng: x 3x 2x (mol)
Sau: (0,3 − x) (0,8 − 3x) 2x (mol)
⟹ nsau = (0,3 − x) + (0,8 − 3x) + 2x = 1,1 − 2x (mol)
Mà ![]() = 10% ⟹
= 10% ⟹ ![]() = 1,1 ⟹ x = 0,05.
= 1,1 ⟹ x = 0,05.
![]() Chọn A.
Chọn A.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia TP Hồ Chí Minh (2 cuốn) ( 140.000₫ )
- Tuyển tập 15 đề thi Đánh giá tư duy Đại học Bách Khoa Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội, TP Hồ Chí Minh (2 cuốn) ( 150.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Ta có ![]()
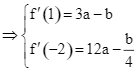
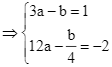
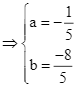 .
.
Vậy ![]() . Chọn B.
. Chọn B.
Câu 2
Lời giải
Kiến thức về Tìm ý chính của bài để đặt tiêu đề
Dịch: Đâu là tiêu đề phù hợp nhất cho bài đọc?
A. Thiết bị mới - Chức năng cũ.
B. Những phát minh trước khi có mạng xã hội.
C. Thời gian sử dụng màn hình trước khi đi ngủ.
D. Thời gian sử dụng màn hình - Thời gian tốt nhất.
=> Bài đọc nói về tác động của việc sử dụng điện thoại, máy tính bảng trước khi đi ngủ.
Chọn C.
Câu 3
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.