* Cho biết nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Cl = 35,5; Fe = 56; Ag = 108.
* Số sóng hấp thụ đặc trưng trên phổ hồng ngoại của một số nhóm chức
Loại hợp chất
Liên kết
hấp thụ
Số sóng (cm-1)
Loại hợp chất
Liên kết
hấp thụ
Số sóng (cm-1)
Aldehyde
C=O
1740 - 1670
Alcohol
O-H
3650 - 3200
C-H
2850 - 2700
Ester
C=O
1750 - 1715
Carboxylic
acid
C=O
1750 - 1680
C-O
1300 - 1000
O-H
3000 - 2500
Ketone
C=O
1740 - 1670
Amine
N-H
3500 - 3200
Thuỷ phân ester X trong môi trường kiềm, thu được sodium acetate và ethanol. Công thức cấu tạo của X là
* Cho biết nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Cl = 35,5; Fe = 56; Ag = 108.
* Số sóng hấp thụ đặc trưng trên phổ hồng ngoại của một số nhóm chức
|
Loại hợp chất |
Liên kết hấp thụ |
Số sóng (cm-1) |
Loại hợp chất |
Liên kết hấp thụ |
Số sóng (cm-1) |
|
Aldehyde |
C=O |
1740 - 1670 |
Alcohol |
O-H |
3650 - 3200 |
|
C-H |
2850 - 2700 |
Ester |
C=O |
1750 - 1715 |
|
|
Carboxylic acid |
C=O |
1750 - 1680 |
C-O |
1300 - 1000 |
|
|
O-H |
3000 - 2500 |
Ketone |
C=O |
1740 - 1670 |
|
|
|
|
|
Amine |
N-H |
3500 - 3200 |
Thuỷ phân ester X trong môi trường kiềm, thu được sodium acetate và ethanol. Công thức cấu tạo của X là
A. CH3COOC2H5.
Quảng cáo
Trả lời:
Đáp án đúng là: A
Công thức cấu tạo của X là CH3COOC2H5. Phương trình hóa học minh họa:
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
Câu hỏi cùng đoạn
Câu 2:
Theo quy định, tất cả các loại chất lỏng, tinh dầu được coi là chất lỏng dễ cháy và là hàng hoá nguy hiểm nếu có điểm chớp cháy nhỏ hơn 60°C không được vận chuyển qua đường hàng không. Cho điểm chớp cháy của một số loại tinh dầu thường gặp như sau:
Tinh dầu
Trầm hương
Quế
Đinh hương
Tràm gió
Oải hương
Thông
Điểm chớp cháy (°C)
51
87
87
52
68
65
Trong các tinh dầu trên, theo quy định có bao nhiêu tinh dầu hành khách không được phép mang theo lên máy bay ?
Theo quy định, tất cả các loại chất lỏng, tinh dầu được coi là chất lỏng dễ cháy và là hàng hoá nguy hiểm nếu có điểm chớp cháy nhỏ hơn 60°C không được vận chuyển qua đường hàng không. Cho điểm chớp cháy của một số loại tinh dầu thường gặp như sau:
|
Tinh dầu |
Trầm hương |
Quế |
Đinh hương |
Tràm gió |
Oải hương |
Thông |
|
Điểm chớp cháy (°C) |
51 |
87 |
87 |
52 |
68 |
65 |
Trong các tinh dầu trên, theo quy định có bao nhiêu tinh dầu hành khách không được phép mang theo lên máy bay ?
A. 2.
Đáp án đúng là: A
Có 2 tinh dầu hành khách không được phép mang theo lên máy bay là trầm hương và tràm gió.
Câu 3:
Hợp chất hữu cơ X có công thức phân tử CxHyO. Trên phổ phổ khối lượng MS, X có giá trị lớn nhất là 60 và phổ hồng ngoại IR, X có tín hiệu hấp thụ trong vùng 3500 - 3200 cm-1. Số đồng phân cấu tạo của X là
Hợp chất hữu cơ X có công thức phân tử CxHyO. Trên phổ phổ khối lượng MS, X có giá trị lớn nhất là 60 và phổ hồng ngoại IR, X có tín hiệu hấp thụ trong vùng 3500 - 3200 cm-1. Số đồng phân cấu tạo của X là
A. 4.
Đáp án đúng là: D
Ta có: MX = 12x + y + 16 = 60 ⇒ 12x + y = 44.
Với y ≤ 2x + 2 và y chẵn nên x = 3, y = 8 là nghiệm duy nhất. Vậy công thức phân tử của X là C3H8O.
Tín hiệu 3500 – 3200 cm-1 là của liên kết O-H alcohol → X có 2 đồng phân cấu tạo là: CH3CH2CH2OH;
(CH3)2CHOH.
Câu 4:
Cao su Buna-S (hay còn gọi là cao su SBR) là loại cao su tổng hợp được sử dụng rất phổ biến, ước tính 50% lốp xe được làm từ SBR. Thực hiện phản ứng trùng hợp các chất nào dưới đây thu được sản phẩm là cao su Buna-S?
Cao su Buna-S (hay còn gọi là cao su SBR) là loại cao su tổng hợp được sử dụng rất phổ biến, ước tính 50% lốp xe được làm từ SBR. Thực hiện phản ứng trùng hợp các chất nào dưới đây thu được sản phẩm là cao su Buna-S?
A. CH2=CH-CH=CH2 và CH2=CH-CN.
B. CH2=CH-CH=CH2 và CH2=CH-Cl.
Đáp án đúng là: C
Đồng trùng hợp CH2=CH-CH=CH2 (butadiene) và C6H5CH=CH2 (styrene) thu được sản phẩm là cao su buna-S.
Câu 5:
Trong phản ứng với nước bromine, aniline thể hiện phản ứng nào sau đây?
Trong phản ứng với nước bromine, aniline thể hiện phản ứng nào sau đây?
A. Phản ứng cộng hợp halogen vào vòng benzene.
B. Phản ứng cộng halogen vào nhóm -NH2.
C. Phản ứng thế hydrogen trên vòng benzene.
Đáp án đúng là: C
Trong phản ứng với nước bromine, aniline thể hiện phản ứng thế hydrogen trên vòng benzene.
Câu 6:
Cho phản ứng hoá học: Cu + 2Fe3+ → Cu2+ + 2Fe2+. Phát biểu nào sau đây về phản ứng trên không đúng?
Cho phản ứng hoá học: Cu + 2Fe3+ → Cu2+ + 2Fe2+. Phát biểu nào sau đây về phản ứng trên không đúng?
A. Cu bị Fe3+ oxi hoá thành Cu2+.
B. Cu2+ có tính oxi hoá mạnh hơn Fe3+.
Đáp án đúng là: B
B không đúng, Fe3+ có tính oxi hoá mạnh hơn Cu2+.
Câu 7:
Kim loại nào sau đây thuộc nhóm IA trong bảng tuần hoàn?
Kim loại nào sau đây thuộc nhóm IA trong bảng tuần hoàn?
A. Ba.
Đáp án đúng là: C
Na (Z = 11: 1s22s22p63s1) thuộc nhóm IA trong bảng tuần hoàn.
Câu 8:
Hầu hết các loại rau và cây ăn trái phát triển tốt nhất trong đất có độ pH từ 6,0 đến 7,0. Trong quá trình trồng trọt, nếu đất có pH = 4,5 đến 5,0 thì người nông dân sử dụng vôi sống để bón vào đất một cách hợp lý. Công thức vôi sống là
Hầu hết các loại rau và cây ăn trái phát triển tốt nhất trong đất có độ pH từ 6,0 đến 7,0. Trong quá trình trồng trọt, nếu đất có pH = 4,5 đến 5,0 thì người nông dân sử dụng vôi sống để bón vào đất một cách hợp lý. Công thức vôi sống là
A. Ca(HCO3)2.
Đáp án đúng là: D
Vôi sống là CaO, vôi sống tác dụng với acid tạo thành muối, từ đó làm giảm lượng acid có trong đất nên pH tăng.
Câu 9:
Nước cứng gây nhiều tác hại trong đời sống và sản xuất như đóng cặn đường ống dẫn nước, làm cho xà phòng có ít bọt khi giặt quần áo, làm giảm mùi vị thực phẩm khi nấu ăn. Nước cứng là nước có chứa nhiều các ion
Nước cứng gây nhiều tác hại trong đời sống và sản xuất như đóng cặn đường ống dẫn nước, làm cho xà phòng có ít bọt khi giặt quần áo, làm giảm mùi vị thực phẩm khi nấu ăn. Nước cứng là nước có chứa nhiều các ion
A. Cl− và SO42-.
Đáp án đúng là: B
Nước cứng là nước có chứa nhiều các ion Mg2+ và Ca2+.
Câu 10:
Copper có độ tinh khiết cao có khả năng dẫn điện tốt, bền về mặt hoá học nên được sử dụng rộng rãi trong các thiết bị điện tử. Copper có độ tinh khiết cao có thể thu được từ copper có độ tinh khiết thấp qua quá trình tinh luyện bằng phương pháp:
Copper có độ tinh khiết cao có khả năng dẫn điện tốt, bền về mặt hoá học nên được sử dụng rộng rãi trong các thiết bị điện tử. Copper có độ tinh khiết cao có thể thu được từ copper có độ tinh khiết thấp qua quá trình tinh luyện bằng phương pháp:
A. điện phân dung dịch CuSO4 với anode làm bằng Pt và cathode là vật bằng Cu với độ tinh khiết cao.
B. điện phân dung dịch CuSO4 với cathode làm bằng Cu có độ tinh khiết cao và anode là vật bằng Cu với độ tinh khiết thấp.
C. điện phân dung dịch CuSO4 với cathode làm bằng Cu có độ tinh khiết thấp và anode là vật bằng Cu với độ tinh khiết cao.
Đáp án đúng là: B
Tinh chế đồng bằng cách điện phân dung dịch CuSO4 với cathode làm bằng Cu có độ tinh khiết cao và anode là vật bằng Cu với độ tinh khiết thấp.
Tại anode: Cu → Cu2+ + 2e
Tại cathode: Cu2+ + 2e → Cu
Câu 11:
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hoá - khử như sau:
Cặp oxi hóa - khử
Fe2+/Fe
Ni2+/Ni
Sn2+/Sn
Cu2+/Cu
Ag+/Ag
Thế điện cực chuẩn
-0,440
-0,257
-0,137
+0,340
+0,799
Pin Galvani được thiết lập từ 2 cặp oxi hóa - khử trong số các cặp oxi hóa khử trên có suất điện động lớn nhất là
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hoá - khử như sau:
|
Cặp oxi hóa - khử |
Fe2+/Fe |
Ni2+/Ni |
Sn2+/Sn |
Cu2+/Cu |
Ag+/Ag |
|
Thế điện cực chuẩn |
-0,440 |
-0,257 |
-0,137 |
+0,340 |
+0,799 |
Pin Galvani được thiết lập từ 2 cặp oxi hóa - khử trong số các cặp oxi hóa khử trên có suất điện động lớn nhất là
A. Ni2+/Ni và Cu2+/Cu.
B. Sn2+/Sn và Ag+/Ag.
Đáp án đúng là: C
Thế điện cực chuẩn càng chênh lệch, pin Galvani có sức điện động càng lớn → Các cặp Fe2+/Fe và Ag+/Ag tạo pin có sức điện động lớn nhất.
Câu 12:
Cho peptide X có công thức cấu tạo:
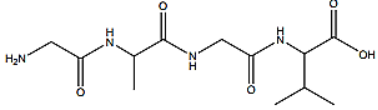
Phát biểu nào sau đây không đúng?
Cho peptide X có công thức cấu tạo:

Phát biểu nào sau đây không đúng?
A. X có thể tham gia phản ứng với dung dịch acid HCl thu được muối.
B. Thủy phân hoàn toàn X trong NaOH dư thu được 4 muối.
C. Phân tử X có 3 liên kết peptide.
Đáp án đúng là: B
X là Gly-Ala-Gly-Val. Thủy phân hoàn toàn X trong NaOH dư thu được 3 muối:
Gly-Ala-Gly-Val + 4NaOH → 2GlyNa + AlaNa + ValNa + H2O
Câu 13:
Sắt (iron) được sử dụng làm lõi trong nam châm điện, chế tạo động cơ điện và máy phát điện, chế tạo biến áp, sử dụng trong thiết bị y tế (Máy MRI (Magnetic Resonance Imaging) để tạo ra từ trường mạnh, giúp chụp ảnh chi tiết bên trong cơ thể). Ứng dụng trên dựa trên tính chất nào sau đây của sắt?
Sắt (iron) được sử dụng làm lõi trong nam châm điện, chế tạo động cơ điện và máy phát điện, chế tạo biến áp, sử dụng trong thiết bị y tế (Máy MRI (Magnetic Resonance Imaging) để tạo ra từ trường mạnh, giúp chụp ảnh chi tiết bên trong cơ thể). Ứng dụng trên dựa trên tính chất nào sau đây của sắt?
A. Tính khử.
Đáp án đúng là: B
Sắt (iron) được sử dụng làm lõi trong nam châm điện dựa trên tính nhiễm từ của sắt.
Câu 14:
Cation [Fe(OH2)6]3+ là một phức chất có cấu tạo như hình bên:
![Cation [Fe(OH2)6]3+ là một phức chất có cấu tạo như hình bên: Phát biểu nào sau đây không đúng? (ảnh 1)](https://video.vietjack.com/upload2/quiz_source1/2025/06/blobid2-1749785154.png)
Phát biểu nào sau đây không đúng?
Cation [Fe(OH2)6]3+ là một phức chất có cấu tạo như hình bên:
![Cation [Fe(OH2)6]3+ là một phức chất có cấu tạo như hình bên: Phát biểu nào sau đây không đúng? (ảnh 1)](https://video.vietjack.com/upload2/quiz_source1/2025/06/blobid2-1749785154.png)
Phát biểu nào sau đây không đúng?
A. Liên kết giữa phối tử và nguyên tử trung tâm là liên kết cộng hóa trị.
B. Phức [Fe(OH2)6]3+ có dạng hình bát diện.
C. Trong phức chất có 6 phối tử H2O.
Đáp án đúng là: D
Nguyên tử trung tâm của phức chất [Fe(OH2)6]3+ là ion Fe3+.
Câu 15:
Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
Methyl cinnamate là một ester có công thức phân tử C10H10O2 và có mùi thơm của quả dâu tây (strawberry) được sử dụng trong ngành công nghiệp hương liệu và nước hoa.
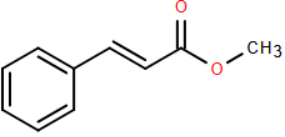
a). Methyl cinnamate phản ứng với Br2/CCl4 theo tỉ lệ 1 : 4.
b). Methyl cinnamate phản ứng với NaOH với tỉ lệ 1 : 2.
c). Methyl cinnamate có đồng phân hình học.
d). Để điều chế methyl cinnamate người ta cho cinnamic acid phản ứng với lượng dư methyl alcohol (H2SO4 đặc, đun nóng nhẹ). Đun nóng 22,2 gam cinnamic acid với methyl alcohol dư, hiệu suất phản ứng 60% thu được 14,58 gam methyl cinnamate.
Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
Methyl cinnamate là một ester có công thức phân tử C10H10O2 và có mùi thơm của quả dâu tây (strawberry) được sử dụng trong ngành công nghiệp hương liệu và nước hoa.

a). Methyl cinnamate phản ứng với Br2/CCl4 theo tỉ lệ 1 : 4.
b). Methyl cinnamate phản ứng với NaOH với tỉ lệ 1 : 2.
c). Methyl cinnamate có đồng phân hình học.
d). Để điều chế methyl cinnamate người ta cho cinnamic acid phản ứng với lượng dư methyl alcohol (H2SO4 đặc, đun nóng nhẹ). Đun nóng 22,2 gam cinnamic acid với methyl alcohol dư, hiệu suất phản ứng 60% thu được 14,58 gam methyl cinnamate.
Đáp án đúng là:
a). Sai, methyl cinnamate phản ứng với Br2/CCl4 theo tỉ lệ 1 : 1, phản ứng xảy ra vào liên kết đôi C = C ngoài vòng benzene.
b). Sai, methyl cinnamate là ester đơn chức của carboxylic acid và alcohol nên phản ứng với NaOH với tỉ lệ 1 : 1.
c). Đúng. Methyl cinnamate có đồng phân hình học.
(d) Đúng:
C6H5CH=CH-COOH + CH3OH ⇋ C6H5CH=CH-COOCH3 + H2O
Câu 16:
Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
Trong phòng thí nghiệm, một nhóm học sinh tìm hiểu phản ứng giữa kim loại đồng (copper) và dung dịch silver nitrate (AgNO3). Giả thuyết của nhóm học sinh là “khi nhúng lá đồng trong dung dịch silver nitrate, lá đồng tan bớt, có kim loại bạc (silver) bám trên lá đồng”. Để kiểm tra giả thuyết này, nhóm học sinh đã thực hiện thí nghiệm như sau :
- Cân một lá đồng, xác định được khối lượng là đồng ban đầu là 5,24 gam.
- Nhúng lá đồng vừa cân được vào dung dịch silver nitrate.
- Sau một thời gian lấy lá đồng ra, làm khô, cân lại thấy khối lượng lá đồng là 5,39 gam.
a). Đã có 0,15 gam kim loại bạc bám trên lá đồng.
b). Giả thuyết của nhóm học sinh là đúng.
c). Dung dịch từ không màu chuyển sang màu xanh.
d). Thí nghiệm trên chứng minh tính oxi hóa của ion Ag+ mạnh hơn tính oxi hóa của ion Cu2+.
Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
Trong phòng thí nghiệm, một nhóm học sinh tìm hiểu phản ứng giữa kim loại đồng (copper) và dung dịch silver nitrate (AgNO3). Giả thuyết của nhóm học sinh là “khi nhúng lá đồng trong dung dịch silver nitrate, lá đồng tan bớt, có kim loại bạc (silver) bám trên lá đồng”. Để kiểm tra giả thuyết này, nhóm học sinh đã thực hiện thí nghiệm như sau :
- Cân một lá đồng, xác định được khối lượng là đồng ban đầu là 5,24 gam.
- Nhúng lá đồng vừa cân được vào dung dịch silver nitrate.
- Sau một thời gian lấy lá đồng ra, làm khô, cân lại thấy khối lượng lá đồng là 5,39 gam.
a). Đã có 0,15 gam kim loại bạc bám trên lá đồng.
b). Giả thuyết của nhóm học sinh là đúng.
c). Dung dịch từ không màu chuyển sang màu xanh.
d). Thí nghiệm trên chứng minh tính oxi hóa của ion Ag+ mạnh hơn tính oxi hóa của ion Cu2+.
Đáp án đúng là:
a). Sai
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
nCu phản ứng = x mol ⇒ nAg = 2x mol.
⇒ mAg bám trên lá đồng = 108.2x = 0,2132 gam.
b). Đúng, khi nhúng lá đồng trong dung dịch silver nitrate, lá đồng tan bớt, có kim loại bạc (silver) bám trên lá đồng.
c). Đúng, dung dịch chuyển sang màu xanh do tạo Cu2+ có màu xanh.
d). Đúng, Ag+ oxi hóa được Cu thành Cu2+ nên Ag+ có tính oxi hóa mạnh hơn Cu2+.
Câu 17:
Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
Tiến hành thí nghiệm: Xác định hàm lượng muối Fe(II) bằng dung dịch thuốc tím.
• Bước 1: Dùng pipette hút chính xác 5 ml dung dịch FeSO4 nồng độ a mol/L cho vào bình định mức loại 50 mL. Thêm tiếp nước cất và định mức đến vạch, thu được 50 mL dung dịch Y.
• Bước 2: Dùng pipette lấy 10,0 mL dung dịch Y cho vào bình tam giác; thêm tiếp khoảng 10 mL dung dịch H2SO4 10% (lấy bằng ống đong). Cho dung dịch KMnO4 nồng độ 0,02M vào burette, mở khoá burette, nhỏ từng giọt dung dịch xuống bình tam giác, lắc đều. Ban đầu dung dịch trong bình tam giác xuất hiện màu hồng rồi mất màu. Tiếp tục chuẩn độ đến khi màu hồng tồn tại bền trong khoảng 20 giây thì dừng chuẩn độ.
Tiến hành 3 lần chuẩn độ thu được kết quả như sau :
Lần chuẩn độ
Lần 1
Lần 2
Lần 3
Thể tích KMnO4 (mL)
8,7
8,9
8,8
a). Phương trình phản ứng chuẩn độ là: 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O.
b). Điểm tương đương là lúc dung dịch xuất hiện màu hồng ổn định khoảng 20 giây.
c). Tiến hành ngược lại cho dung dịch KMnO4 vào bình tam giác, dung dịch Y vào burette chúng ta cũng thu được kết quả tương tự.
d). Giá trị của a là 0,88.
Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
Tiến hành thí nghiệm: Xác định hàm lượng muối Fe(II) bằng dung dịch thuốc tím.
• Bước 1: Dùng pipette hút chính xác 5 ml dung dịch FeSO4 nồng độ a mol/L cho vào bình định mức loại 50 mL. Thêm tiếp nước cất và định mức đến vạch, thu được 50 mL dung dịch Y.
• Bước 2: Dùng pipette lấy 10,0 mL dung dịch Y cho vào bình tam giác; thêm tiếp khoảng 10 mL dung dịch H2SO4 10% (lấy bằng ống đong). Cho dung dịch KMnO4 nồng độ 0,02M vào burette, mở khoá burette, nhỏ từng giọt dung dịch xuống bình tam giác, lắc đều. Ban đầu dung dịch trong bình tam giác xuất hiện màu hồng rồi mất màu. Tiếp tục chuẩn độ đến khi màu hồng tồn tại bền trong khoảng 20 giây thì dừng chuẩn độ.
Tiến hành 3 lần chuẩn độ thu được kết quả như sau :
|
Lần chuẩn độ |
Lần 1 |
Lần 2 |
Lần 3 |
|
Thể tích KMnO4 (mL) |
8,7 |
8,9 |
8,8 |
a). Phương trình phản ứng chuẩn độ là: 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O.
b). Điểm tương đương là lúc dung dịch xuất hiện màu hồng ổn định khoảng 20 giây.
c). Tiến hành ngược lại cho dung dịch KMnO4 vào bình tam giác, dung dịch Y vào burette chúng ta cũng thu được kết quả tương tự.
d). Giá trị của a là 0,88.
Đáp án đúng là:
a). Đúng, phương trình phản ứng chuẩn độ là:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
b). Sai, điểm tương đương là thời điểm lượng KMnO4 chảy xuống đạt đúng tỉ lệ Đây là điểm mong muốn nhất nhưng không nhận ra được.
“Dung dịch xuất hiện màu hồng ổn định khoảng 20 giây” là điểm kết thúc chuẩn độ, đây là điểm mà KMnO4 đã dư một chút và lượng dư này báo hiệu cho người làm dừng lại thông qua sự thay đổi màu sắc.
c). Sai, nếu làm ngược lại kết quả sẽ kém chính xác hơn, vì màu sắc từ tím chuyển hồng rồi nhạt dần đến khi mất hẳn, rất khó để xác định điểm kết thúc.
(d) Đúng,
Câu 18:
Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
Một nhóm học sinh tiến hành thí nghiệm so sánh tốc độ phản ứng thủy phân của các dẫn xuất halogen khác nhau của alkane. Giả thuyết của nhóm học sinh là: “liên kết cộng hóa trị giữa nguyên tử carbon và nguyên tử halogen (kí hiệu chung là X) càng phân cực thì tốc độ phản ứng thủy phân càng lớn”. Phương trình hóa học của phản ứng thủy phân như sau:
CnH2n+1X + H2O → CnH2n+1OH + HX (∗)
Nhóm học sinh tiến hành như sau:
• Bước 1: Chuẩn bị nước nóng khoảng 50°C bằng cách đun ¾ cốc nước 250 mL. Chuẩn bị ba ống nghiệm, mỗi ống chứa 5 mL ethanol và 4 giọt lần lượt các hợp chất: 1-iodobutane, 1-bromobutane, 1-chlorobutane, có dán nhãn. Đặt các ống nghiệm này vào cốc nước để làm nóng. Cho 5 mL dung dịch AgNO3 0,05M vào ba ống nghiệm khác và cũng đặt vào cốc nước.
• Bước 2: Khi các dung dịch đã ổn định nhiệt, cho nhanh dung dịch AgNO3 0,05M vào ống nghiệm chứa 1-chlorobutane và ethanol, bấm giờ. Ghi thời gian xuất hiện kết tủa (dung dịch chuyển đục).
• Bước 3: Lặp lại bước 2 cho hai ống nghiệm chứa dung dịch dẫn xuất halogen còn lại.
Kết quả như sau:
Hợp chất
1-iodobutane
1-bromobutane
1-chlorobutane
Thời gian (giây)
52
87
606
a). Từ kết quả thí nghiệm, kết luận giả thuyết của nhóm học sinh là sai.
b). Ở bước 1, đã xảy ra phản ứng hóa học (∗).
c). Độ phân cực liên kết giảm dần theo thứ tự C – Cl; C – I; C – Br.
d). Không thực hiện ngâm ống nghiệm chứa dung dịch AgNO3 0,05M vào nước nóng thì kết tủa sẽ xuất hiện sớm hơn.
Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
Một nhóm học sinh tiến hành thí nghiệm so sánh tốc độ phản ứng thủy phân của các dẫn xuất halogen khác nhau của alkane. Giả thuyết của nhóm học sinh là: “liên kết cộng hóa trị giữa nguyên tử carbon và nguyên tử halogen (kí hiệu chung là X) càng phân cực thì tốc độ phản ứng thủy phân càng lớn”. Phương trình hóa học của phản ứng thủy phân như sau:
CnH2n+1X + H2O → CnH2n+1OH + HX (∗)
Nhóm học sinh tiến hành như sau:
• Bước 1: Chuẩn bị nước nóng khoảng 50°C bằng cách đun ¾ cốc nước 250 mL. Chuẩn bị ba ống nghiệm, mỗi ống chứa 5 mL ethanol và 4 giọt lần lượt các hợp chất: 1-iodobutane, 1-bromobutane, 1-chlorobutane, có dán nhãn. Đặt các ống nghiệm này vào cốc nước để làm nóng. Cho 5 mL dung dịch AgNO3 0,05M vào ba ống nghiệm khác và cũng đặt vào cốc nước.
• Bước 2: Khi các dung dịch đã ổn định nhiệt, cho nhanh dung dịch AgNO3 0,05M vào ống nghiệm chứa 1-chlorobutane và ethanol, bấm giờ. Ghi thời gian xuất hiện kết tủa (dung dịch chuyển đục).
• Bước 3: Lặp lại bước 2 cho hai ống nghiệm chứa dung dịch dẫn xuất halogen còn lại.
Kết quả như sau:
|
Hợp chất |
1-iodobutane |
1-bromobutane |
1-chlorobutane |
|
Thời gian (giây) |
52 |
87 |
606 |
a). Từ kết quả thí nghiệm, kết luận giả thuyết của nhóm học sinh là sai.
b). Ở bước 1, đã xảy ra phản ứng hóa học (∗).
c). Độ phân cực liên kết giảm dần theo thứ tự C – Cl; C – I; C – Br.
d). Không thực hiện ngâm ống nghiệm chứa dung dịch AgNO3 0,05M vào nước nóng thì kết tủa sẽ xuất hiện sớm hơn.
Đáp án đúng là:
Thời gian xuất hiện kết tủa AgX càng nhanh khi lượng HX tạo ra càng nhanh, tốc độ thủy phân càng lớn.
Từ kết quả thí nghiệm ta thấy khả năng thủy phân CH3CH2CH2CH2I > CH3CH2CH2CH2Br > CH3CH2CH2CH2Cl do năng lượng liên kết C-I < C-Br < C-Cl.
Độ phân cực của liên kết phụ thuộc sự chênh lệch của độ âm điện. Độ âm điện I < Br < Cl nên độ phân cực C-I < C-Br < C-Cl.
a). Đúng, kết quả thí nghiệm ngược lại với giả thuyết nên giả thuyết trên là sai. Độ phân cực không quyết định một chất thủy phân dễ hay khó mà năng lượng liên kết mới thước đo về khả năng phân cắt liên kết trong phản ứng thủy phân.
b). Sai, phản ứng thủy phân khá chậm, đến bước 2 cũng phải thêm thời gian phản ứng mới xảy ra (ví dụ sau 52s thì CH3CH2CH2CH2I mới bị thủy phân, coi như Ag+ kết hợp I− ngay lập tức khi I− vừa tách ra).
c). Sai, độ phân cực giảm dần theo thứ tự: C – Cl; C – Br; C – I.
d). Sai, không ngâm dung dịch AgNO3 0,05M vào nước nóng thì kết tủa sẽ xuất muộn hơn do dung dịch AgNO3 làm nguội hỗn hợp phản ứng.
Câu 19:
Điện khí, hay còn được gọi là điện được sản xuất từ khí tự nhiên, điển hình nhất là LNG (Liquefied Natural Gas). Đầu tiên, khí tự nhiên được khai thác tại các mỏ khí, được làm sạch và làm lạnh để chuyển đổi thành khí thiên nhiên hóa lòng LNG (thuận tiện cho việc tồn trữ và vận chuyển; thành phần chứa 95% CH4, 5% C2H6 về số mol). Sau đó, LNG được vận chuyển tới các nhà máy điện khí để tạo ra điện năng. Một nhà máy điện khí có sản lượng điện 3,6.106 kWh/ngày (1 kWh = 3600 kJ), các nhiên liệu bị đốt cháy hoàn toàn (biết 60% nhiệt lượng tỏa ra của quá trình đốt cháy được chuyển hóa thành điện năng). Biết CH4, C2H6 cháy theo các phương trình:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
C2H6(g) + 3,5O2(g) → 2CO2(g) + 3H2O(g)
Chất
CH4(g)
C2H6(g)
CO2(g)
H2O(g)
(kJ/mol)
-74,6
-84,7
-393,5
-241,8
Mỗi ngày nhà máy điện khí cần sử dụng bao nhiêu tấn LNG (Chỉ làm tròn phép tính cuối, làm tròn đến hàng đơn vị)
Điện khí, hay còn được gọi là điện được sản xuất từ khí tự nhiên, điển hình nhất là LNG (Liquefied Natural Gas). Đầu tiên, khí tự nhiên được khai thác tại các mỏ khí, được làm sạch và làm lạnh để chuyển đổi thành khí thiên nhiên hóa lòng LNG (thuận tiện cho việc tồn trữ và vận chuyển; thành phần chứa 95% CH4, 5% C2H6 về số mol). Sau đó, LNG được vận chuyển tới các nhà máy điện khí để tạo ra điện năng. Một nhà máy điện khí có sản lượng điện 3,6.106 kWh/ngày (1 kWh = 3600 kJ), các nhiên liệu bị đốt cháy hoàn toàn (biết 60% nhiệt lượng tỏa ra của quá trình đốt cháy được chuyển hóa thành điện năng). Biết CH4, C2H6 cháy theo các phương trình:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
C2H6(g) + 3,5O2(g) → 2CO2(g) + 3H2O(g)
|
Chất |
CH4(g) |
C2H6(g) |
CO2(g) |
H2O(g) |
|
(kJ/mol) |
-74,6 |
-84,7 |
-393,5 |
-241,8 |
Mỗi ngày nhà máy điện khí cần sử dụng bao nhiêu tấn LNG (Chỉ làm tròn phép tính cuối, làm tròn đến hàng đơn vị)
Đáp án đúng là: 433
Đặt:
Quá trình chuyển hóa năng lượng:
Vậy mLNG = 16.95x + 30.5x = 432642487 gam ≈ 433 tấn.
Câu 20:
Từ 500 tấn quặng hematite chứa 85% Fe2O3 sản xuất được x nghìn chiếc nồi gang có hàm lượng sắt là 95%. Biết rằng mỗi chiếc nồi gang nặng 5 kg và hiệu suất của toàn bộ quá trình là 80%. Giá trị của x là bao nhiêu (kết quả làm tròn đến hàng đơn vị)?
Từ 500 tấn quặng hematite chứa 85% Fe2O3 sản xuất được x nghìn chiếc nồi gang có hàm lượng sắt là 95%. Biết rằng mỗi chiếc nồi gang nặng 5 kg và hiệu suất của toàn bộ quá trình là 80%. Giá trị của x là bao nhiêu (kết quả làm tròn đến hàng đơn vị)?
Đáp án đúng là: 50
Khối lượng Fe2O3 có trong 500 tấn quặng hemantite là: 500.0,85 = 425 tấn.
Bảo toàn Fe, khối lượng Fe thu được từ 425 tấn Fe2O3 là:
tấn.
Số lượng nồi gang sản xuất được là: chiếc.
Câu 21:
Ion Na+ là một trong những chất điện giải quan trọng trong cơ thể con người, và lượng tiêu thụ của nó có ảnh hưởng lớn đến sức khỏe. Các chuyên gia khuyến nghị rằng lượng sodium hàng ngày của một người trưởng thành không nên vượt quá 2400 mg. Bột ngọt (mì chính) là muối sodium của glutamic acid với công thức C5H8NO4Na. Hỏi khi tiêu thụ 1,0 g bột ngọt, lượng natri trong đó tương đương với bao nhiêu gam muối ăn (NaCl)? (làm tròn kết quả đến hàng phần trăm)
Ion Na+ là một trong những chất điện giải quan trọng trong cơ thể con người, và lượng tiêu thụ của nó có ảnh hưởng lớn đến sức khỏe. Các chuyên gia khuyến nghị rằng lượng sodium hàng ngày của một người trưởng thành không nên vượt quá 2400 mg. Bột ngọt (mì chính) là muối sodium của glutamic acid với công thức C5H8NO4Na. Hỏi khi tiêu thụ 1,0 g bột ngọt, lượng natri trong đó tương đương với bao nhiêu gam muối ăn (NaCl)? (làm tròn kết quả đến hàng phần trăm)
Đáp án đúng là: 0,35
Bảo toàn Na:
Câu 22:
Một mẫu nước thải của nhà máy sản xuất có pH = 3. Để thải ra ngoài môi trường thì cần phải tăng pH lên từ 5,8 đến 8,6 (theo đúng qui định), nhà máy phải dùng vôi sống thả vào nước thải. Để nâng pH của 4 m³ nước thải từ 3 lên 7 cần dùng m gam vôi sống. Tính giá trị m. (Bỏ qua sự thủy phân của các muối, kết quả làm tròn đến hàng đơn vị).
Một mẫu nước thải của nhà máy sản xuất có pH = 3. Để thải ra ngoài môi trường thì cần phải tăng pH lên từ 5,8 đến 8,6 (theo đúng qui định), nhà máy phải dùng vôi sống thả vào nước thải. Để nâng pH của 4 m³ nước thải từ 3 lên 7 cần dùng m gam vôi sống. Tính giá trị m. (Bỏ qua sự thủy phân của các muối, kết quả làm tròn đến hàng đơn vị).
Đáp án đúng là: 112
pH = 3 → [H+] = 0,001M
Để có pH = 7 thì cần cung cấp nOH- = nH+ = 0,001.4.10³ = 4 mol.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Sổ tay Hóa học 12 (chương trình mới) ( 18.000₫ )
- 1200 câu hỏi lí thuyết Hóa học (Form 2025) ( 38.000₫ )
- Tổng ôn lớp 12 môn Toán, Lí, Hóa, Văn, Anh, Sinh Sử, Địa, KTPL (Form 2025) ( 36.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án đúng là: 2
Đặt nAl = 0,2; nCO = x; nCO2 = 4x (đơn vị đều là triệu mol)
Bảo toàn electron: 0,2.3 = 2x + 4.4x
⇒ x = 1/30 → mC = 12.5x = 2 tấn.
Câu 2
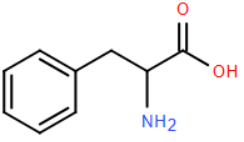
A. Ở môi trường có pH = 2, phenylalanine di chuyền về phía điện cực dương trong điện trường.
B. Phenylalanine là một amino acid thiết yếu có mặt trong các thực phẩm chứa protein.
C. Phenylalanine là chất lưỡng tính.
Lời giải
Đáp án đúng là: A
Phe có 1 -NH2 và 1 -COOH nên pI ≈ 6. Tại pH = 2 Phe tồn tại dạng cation và di chuyển về cực âm trong điện trường.
Câu 3
A. Chất dẻo, nền.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
A. polysaccharide.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.