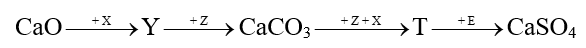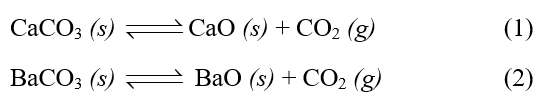Để đánh giá mức độ tự diễn biến của một phản ứng tại nhiệt độ T, người ta dựa vào đại lượng biến thiên năng lượng tự do Gibbs \[({\Delta _r}G_T^o).\] Nếu \[{\Delta _r}G_T^o > 0\]: phản ứng không tự xảy ra; \[{\Delta _r}G_T^o < 0\]: phản ứng tự xảy ra.
Giá trị của đại lượng này được tính theo biểu thức:
\[{\Delta _r}G_T^o = {\rm{ }}{\Delta _r}H_T^o - {\rm{ }}T{\Delta _r}S_T^o.\] Trong đó
- T: nhiệt độ tính theo thang Kelvin (K);
- \[{\Delta _r}H_T^o\]: Biến thiên enthalpy của phản ứng;
- \[{\Delta _r}S_T^o\]: Biến thiên entropy của phản ứng (đại lượng đặc trưng cho độ mất trật tự của hệ ở một trạng thái và điều kiện xác định).
Tính giá trị thấp nhất của T (làm tròn đến hàng đơn vị) để phản ứng sau tự xảy ra:
CaCO₃(s) → CaO(s) + CO₂(g)
Cho biết: \[{\Delta _r}S_T^o = 159,26{\rm{ }}J/mo{l^{ - 1}}.{K^{ - 1}}\]và nhiệt tạo thành chuẩn của các chất như sau:
|
Chất |
CaCO₃(s) |
CaO(s) |
CO₂(g) |
|
\[{\Delta _f}H_{298}^o(kJ.mo{l^{ - 1}})\] |
-1207,0 |
-635,0 |
-393,5 |
Giả sử \[{\Delta _r}H_T^o\] và \[{\Delta _r}S_T^o\] của quá trình không phụ thuộc vào nhiệt độ.
Quảng cáo
Trả lời:

Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1
Giá trị biến thiên enthalpy chuẩn của phản ứng nhiệt phân muối nitrate của kim loại nhóm IIA (R) (R(NO3)2(s) RO(s) + 2NO2(g) + \(\frac{1}{2}\)O2(g)) theo bảng sau:
|
Muối R(NO3)2(s) |
Mg(NO3)2 |
Ca(NO3)2 |
Sr(NO3)2 |
Ba(NO3)2 |
|
\({\Delta _r}H_{298}^o(kJ)\) |
255,2 |
369,5 |
452,4 |
506,2 |
a) Độ bền nhiệt của các muối nitrate của kim loại nhóm IIA có xu hướng tăng dần từ \[Mg{\left( {N{O_3}} \right)_2}\]tới\[Ba{\left( {N{O_3}} \right)_2}.\]
b) Dựa vào bảng giá trị biến thiên enthalpy chuẩn ở trên có thể dự đoán xu hướng biến đổi độ bền nhiệt của\[R{\left( {N{O_3}} \right)_2}.\]
c) Phản ứng nhiệt phân muối nitrate của kim loại nhóm IIA \[\left( {R{{\left( {N{O_3}} \right)}_2}} \right)\] là phản ứng oxi hoá – khử, trong đó vai trò chất oxi hoá là\[{R^{2 + }}.\;\]
d) Nhiệt độ phân huỷ theo thứ tự sau: \[Mg{\left( {N{O_3}} \right)_2} < {\rm{ }}Ca{\left( {N{O_3}} \right)_2} < {\rm{ }}Sr{\left( {N{O_3}} \right)_2} < {\rm{ }}Ba{\left( {N{O_3}} \right)_2}.\;\]
Lời giải
Hướng dẫn giải:
a. Đúng.
b. Đúng.
c. Sai. Chất đóng vai trò là chất oxi hóa là NO3−.
d. Đúng.
Lời giải
Hướng dẫn giải:
Đáp án đúng là: 850.
Khối lượng đá vôi = \[420.\frac{{100}}{{56}} = 750\] (tấn)
Nhiệt lượng cần cung cấp = 1800.750000 = 1350000000 (kJ)
Khối lượng than đá \[\frac{{1350000000}}{{27000}}.\frac{{100}}{{50}} = 100000\]kg = 100 (tấn)
Tổng khối lượng đá vôi và than đá: 750 + 100 = 850 (tấn).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
A. Na2CO3, H2SO4.
B. CO2, KHSO4.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.