Quảng cáo
Trả lời:
Đáp án đúng là: 48,86
Giải thích:
Gọi phần trăm số nguyên tử của đồng vị \[{}_{19}^{39}K\]là x (%)
⇒ Phần trăm số nguyên tử của đồng vị là \[{}_{19}^{41}K\]là (100 - x) %
Áp dụng công thức tính nguyên tử khối trung bình ta có:
\[{\overline A _K} = 39,13 = \frac{{39x + 41.(100 - x)}}{{100}} \Rightarrow x = 93,5\]
Hay trong tự nhiên đồng vị \[{}_{19}^{39}K\]chiếm 93,5% tổng số nguyên tử.
Giả sử có 1 mol KCl thì tổng số mol các đồng vị của K là 1 mol, trong đó số mol của \[{}_{19}^{39}K\]là \[1.\frac{{93,5}}{{100}} = 0,935\]mol
Vậy thành phần phần trăm về khối lượng của \[{}_{19}^{39}K\] có trong KCl là
\[\% {}_{19}^{39}K = \frac{{0,935.39}}{{39,13 + 35,5}}.100\% = 48,86\% \]
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Theo bài ra, ta có hệ phương trình:
\[\left\{ \begin{array}{l}2Z + N = 52\\1,06Z - N = 0\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}Z = 17\\N = 18\end{array} \right.\]
⇒ Số khối A = Z + N = 17 + 18 = 35.
Kí hiệu nguyên tử X là: \({}_{17}^{35}X.\)
Lời giải
a) Cấu hình electron nguyên tử X: 1s2 2s2 2p6 3s2 hay [Ne] 3s2
X là kim loại do có 2 electron ở lớp ngoài cùng.
b) Cấu hình electron lớp ngoài cùng của X theo AO: 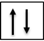
Ở trạng thái cơ bản, X không có electron độc thân.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
A. 1s22s22p63s23p6.
B. 1s22s22p63s23p63d1.
C. 1s22s22p63s23p64s1.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.