Cho phương trình hóa học sau:
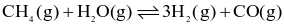
Biết rằng, ở 760 °C các chất đều ở thể khí và nồng độ mol của CH4, H2O, H2 và CO ở trạng thái cân bằng lần lượt là 0,126M; 0,242M; 1,150M và 0,126M.
Tính hằng số cân bằng 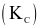 của phản ứng ở 760 °C. (Làm tròn đến hàng phần trăm)
của phản ứng ở 760 °C. (Làm tròn đến hàng phần trăm)
Câu hỏi trong đề: Bài tập ôn tập Hóa 11 Kết nối tri thức Chương 1 có đáp án !!
Quảng cáo
Trả lời:
Đáp án đúng là: 6,29.
Hằng số cân bằng của phản ứng ở 760 oC là:
\({K_C} = \frac{{{{\left[ {{{\rm{H}}_2}} \right]}^3} \cdot [{\rm{CO}}]}}{{\left[ {{\rm{C}}{{\rm{H}}_4}} \right] \cdot \left[ {{{\rm{H}}_2}{\rm{O}}} \right]}} = \frac{{1,{{15}^3} \cdot 0,126}}{{0,126 \cdot 0,242}} \approx 6,29.\)
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Hóa học 11 dùng cho cả 3 bộ sách Kết nối, Cánh diều, Chân trời sáng tạo VietJack - Sách 2025 ( 58.000₫ )
- Trọng tâm Sử, Địa, GD KTPL 11 cho cả 3 bộ Kết nối, Chân trời, Cánh diều VietJack - Sách 2025 ( 38.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Hướng dẫn giải
a - Đúng.
b - Sai. CO2 là chất không điện li.
c - Sai. CO2 cũng là chất không điện li.
d - Sai. CH3COOH là chất điện li yếu.
Lời giải
Đáp án đúng là: 0,25.
\({{\rm{n}}_{{\rm{CuS}}{{\rm{O}}_4}.5{{\rm{H}}_2}{\rm{O}}}} = \frac{{12,5}}{{250}} = 0,05\,(\;{\rm{mol}}).\)
\(\begin{array}{l}{\rm{CuS}}{{\rm{O}}_4} \to {\rm{C}}{{\rm{u}}^{2 + }} + \,\,{\rm{SO}}_4^{2 - }\\0,05\,\,\,\,\,\,\, \to \,\,0,05\,\,\,\,\,0,05\,\,\,\,\,\,(\;{\rm{mol}})\\ \Rightarrow \left[ {{\rm{C}}{{\rm{u}}^{2 + }}} \right] = \frac{{0,05}}{{0,2}} = 0,25\,({\rm{M}}).\end{array}\)
Câu 3
A. giảm nồng độ của khí nitrogen.
B. giảm nồng độ của khí hydrogen.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
(1), (2), (4), (5).
(2), (3), (5).
(2), (3), (4), (6).
(1), (2), (4).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
 .
.
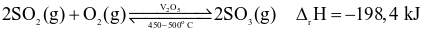 .
.