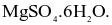Trong quy trình sản xuất sulfuric acid (H2SO4) có giai đoạn dùng dung dịch H2SO4 98% hấp thụ sulfur trioxide (SO2) thu được oleum (H2SO4.nSO3). Sulfur trioxide được tạo thành bằng cách oxi hoá sulfur dioxide bằng oxygen hoặc lượng dư không khí ở nhiệt độ 450°C – 500°C, chất xúc tác vanadium(V) oxide (V2O5) theo phương trình hoá học:
2SO2 (g)+ O2 (g) 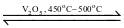 2SO3 (g);
2SO3 (g);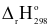 = −198,4 kJ;Kc = 40.
= −198,4 kJ;Kc = 40.
(a) Cân bằng hóa học trên sẽ chuyển dịch theo chiều thuận khi dùng dung dịch H2SO4 98% hấp thu SO3 sinh ra.
(b) Nếu tăng áp suất của hệ phản ứng và giữ nhiệt độ của hệ không đổi thì cân bằng của hệ chuyển dịch theo chiều nghịch.
(c) Nồng độ ban đầu của SO2 và O2 tương ứng là 4M và 2M. Khi đạt đến trạng thái cân bằng đã có 80% SO2 phản ứng.
(d) Nếu tỉ lệ nồng độ mol ban đầu của SO2 và O2 tương ứng là 1:10 thì khi đạt đến trạng thái cân bằng, hiệu suất phản ứng đạt khoảng 90%.
Câu hỏi trong đề: Bài tập ôn tập Hóa 11 Cánh diều Chủ đề 2 có đáp án !!
Quảng cáo
Trả lời:
(a) Đúng.
(b) Sai. Tăng áp suất của hệ, cân bằng chuyển dịch theo chiều giảm số mol khí tức chiều thuận.
(c) Đúng.
(d) Sai. Ta có:
2SO2 + O2 → 2SO3
Ban đầu: 1 10 0
Phản ứng: x 0,5x x
Cân bằng: 1 – x 10 – 0,5x x
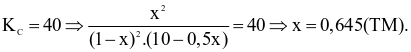
Vậy H khoảng 64,5%.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Hóa học 11 dùng cho cả 3 bộ sách Kết nối, Cánh diều, Chân trời sáng tạo VietJack - Sách 2025 ( 58.000₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 11 VietJack - Sách 2025 theo chương trình mới cho 2k8 ( 45.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
(a) Đúng.
(b) Đúng.
(c) Sai. Mẫu giấy quỳ tím chuyển sang màu xanh.
(d) Đúng.
Lời giải
(a) Đúng.
(b) Sai. Ở ống nghiệm thứ hai thoát ra khí không màu, hóa nâu ngoài không khí.
(c) Đúng.
(d) Sai. NaCl không tác dụng với NO2 nên không thể thay bông tẩm dung dịch NaOH bằng bông tẩm dung dịch NaCl.
Câu 3
6 và 8.
4,5 và 8,5.
4 và 7.
5,5 và 7,5.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
Xút.
Muối ăn.
Giấm ăn.
Cồn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
7,8125.
3,125.
1,25.
0,675.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
 .
. 2NH3. Sau một thời gian phản ứng đạt trạng thái cân bằng, nồng độ các chất trong bình như sau: [N2] = 3M; [H2] = 4M; [NH3] = 2M. Nồng độ mol/L của N2 và H2 ban đầu lần lượt là
2NH3. Sau một thời gian phản ứng đạt trạng thái cân bằng, nồng độ các chất trong bình như sau: [N2] = 3M; [H2] = 4M; [NH3] = 2M. Nồng độ mol/L của N2 và H2 ban đầu lần lượt là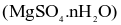 có nhiều ứng dụng: vừa có thể dùng pha chế thuốc nhuận tràng, vừa như một loại phân bón cho cây, hay dung dịch khử khuẩn. Khi làm lạnh 440,0 gam dung dịch
có nhiều ứng dụng: vừa có thể dùng pha chế thuốc nhuận tràng, vừa như một loại phân bón cho cây, hay dung dịch khử khuẩn. Khi làm lạnh 440,0 gam dung dịch 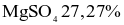 thì có 49,2 gam muối Epsom tách ra, phần dung dịch thu được có nồng độ 24,56%. Biết độ tan của
thì có 49,2 gam muối Epsom tách ra, phần dung dịch thu được có nồng độ 24,56%. Biết độ tan của 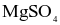 tại
tại 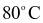 và
và 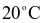 lần lượt là 54,80 gam và 35,10 gam. Khối lượng Epsom được tách ra khi làm lạnh 9288 gam dung dịch bão hòa
lần lượt là 54,80 gam và 35,10 gam. Khối lượng Epsom được tách ra khi làm lạnh 9288 gam dung dịch bão hòa 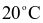 là b gam.
là b gam.