Quảng cáo
Trả lời:
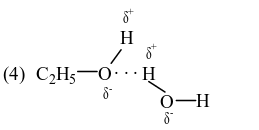
Đáp án đúng là: 4
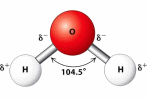
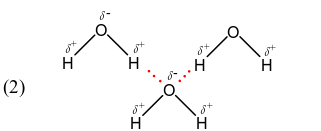
Trong dung dịch ethanol (C2H5OH) có 4 loại liên kết hydrogen.
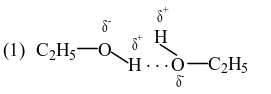
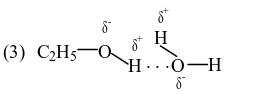
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
a)
Số proton = Số electron = Số hiệu nguyên tử Z = Số thứ tự ô = 16;
Số lớp electron = Số thứ tự chu kì = 3;
Số electron lớp ngoài cùng = Số thứ tự nhóm A = 6;
 Cấu hình electron của S (Z = 16): 1s22s22p63s23p4 hay [Ne]3s23p4.
Cấu hình electron của S (Z = 16): 1s22s22p63s23p4 hay [Ne]3s23p4.
b)
Nguyên tử S có 6 electron ở lớp ngoài cùng.
 S là nguyên tố phi kim.
S là nguyên tố phi kim.
Nguyên tố S thuộc nhóm VIA  Hóa trị cao nhất của S là VI.
Hóa trị cao nhất của S là VI.
 Oxide cao nhất SO3 là acidic oxide và acid tương ứng H2SO4 là acid mạnh.
Oxide cao nhất SO3 là acidic oxide và acid tương ứng H2SO4 là acid mạnh.
Câu 2
C2H5OH.
NH3.
HF.
CH4.
Lời giải
Đáp án đúng là: D
Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng. Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
Vậy CH4 không tạo được liên kết hydrogen giữa các phân tử.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
Phân tử HCl là phân tử phân cực.
Các electron liên kết bị hút lệch về một phía nguyên tử chlorine.
Cặp electron dùng chung nằm chính giữa hai nguyên tử hydrogen và chlorine.
Nguyên tử hydrogen và chlorine liên kết với nhau bằng một liên kết đơn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
2.
3.
4.
5.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
 số lượng phân tử chỉ chứa các liên kết cộng hoá trị không phân cực là
số lượng phân tử chỉ chứa các liên kết cộng hoá trị không phân cực là có cấu tạo như sau:
có cấu tạo như sau: