(0,5 điểm) Flourine (F) có (Z = 9).
Hãy viết công thức Lewis của phân tử F2. Xác định số electron riêng và dùng chung của nguyên tử F trong phân tử và dự đoán khả năng nhường hay nhận electron của nguyên tố flourine khi tham gia các phản ứng hóa học
Quảng cáo
Trả lời:
Công thức Lewis của F2 :
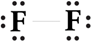
Số electron riêng của F là 6, số electron chung là 2. F có 7 electron lớp vỏ ngoài cùng, nên có xu hướng nhận thêm 1 electron để đạt lớp vỏ octet bền vững
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
|
a. H2O là dung môi phân cực. NH3 là phân tử phân cực và NH3 tạo được liên kết hydrogen với nước nên NH3 tan tốt trong nước. |
|
b. Giữa các phân tử HF có các liên kết hydrogen, còn giữa các phân tử HCl thì không. Do đó nhiệt độ sôi của HF cao hơn đáng kể so với HCl
|
Câu 2
(1 điểm) Cho độ âm điện của các nguyên tố sau:
| Nguyên tố | H | C | Br | K | Na | Cl |
| Độ âm điện | 2,20 | 2,55 | 2,96 | 0,82 | 0,93 | 3,16 |
Cho biết loại liên kết trong các phân tử sau: CH4, NaCl, KBr, HBr. Giải thích.
Lời giải
CH4 chứa liên kết cộng hóa trị không phân cực.
∆χ = 2,55 – 2,2 = 0,35 < 0,4.
HBr chứa liên kết cộng hóa trị phân cực.
0,4 < ∆χ = 2,96 – 2,2 = 0,76 < 1,7
KBr chứa liên kết ion.
∆χ = 2,96 – 0,82 = 2,14 > 1,7
NaCl chứa liên kết ion.
∆χ = 3,16 – 0,93 = 2,23 > 1,7
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
Hình elip và hình số tám nổi.
Hình số tám nổi và hình cầu
Hình cầu và hình lục phương.
Hình cầu và hình số tám nổi.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
X và Y đều phản ứng mãnh liệt với nước ở điều kiện thường.
X thuộc nhóm IA và Y thuộc nhóm IIA.
X là nguyên tố p.
Tính kim loại của X lớn hơn Y.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
1s22s22p63s23p4
1s22s22p63s23p5
1s22s22p63s1
1s22s22p6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
bán kính nguyên tử giảm dần, tính kim loại tăng dần.
bán kính nguyên tử giảm dần, tính phi kim tăng dần.
bán kính nguyên tử tăng dần, tính phi kim tăng dần.
bán kính nguyên tử tăng dần, tính kim loại giảm dần.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.