Hòa tan hết 33,2 gam hỗn hợp X gồm FeO và Fe3O4 trong 1,2 lít dung dịch chứa KHSO4 1M và HNO3 0,5M thu được dung dịch Y và hỗn hợp khí Z gồn NO và NO2 có tỷ khối hơi so với H2 bằng 17,67 (ngoài ra không còn sản phẩm khử nào khác). Chia dung dịch Y thành 2 phần bằng nhau:
- Phần I cho tác dụng hết với 900 ml dung dịch NaOH 0,5M. Sau phản ứng thu được 10,7 gam một kết tủa duy nhất.
- Phần II cho tác dụng với dung dịch Ba(OH)2 dư thì thu được m gam kết tủa.
Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 150,5.
B. 128,9.
C. 163,875.
D. 142,275.
Quảng cáo
Trả lời:
Chọn đáp án C
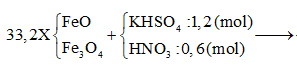
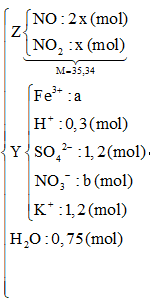
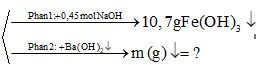
Dùng quy tắc đường chéo => nNO : nN2O = 2 : 1
Gọi số mol của NO và của N2O lần lượt là 2x và x (mol)
Phần 1: tác dụng với 0,45 mol NaOH → 0,1 mol Fe(OH)3
=> nOH- dùng để trung hòa H+ dư = 0,45 – 3nFe(OH)3 = 0,45 – 0,3 = 0,15 (mol)
=> nH+ dư = 0,15.2 = 0,3 (mol)
Ta có: ∑nH+ bđ = nKHSO4 + nHNO3 = 1,2 + 0,6 = 1,8 (mol)
BTNT H : => nH+ bđ = nH+ dư + 2nH2O => nH2O = ( 1,8 – 0,3)/2 = 0,75 (mol)
BTNT N : 0,6 = 2x + x + b
=> 3x + b = 0,6 (1)
BTĐT đối với các chất trong dd Y: 3a + 0,3+ 1,2 = 2.1,2 + b
=> 3a – b = 0,9 (2)
BTKL: mX + mKHSO4 + mHNO3 = mY + mZ + mH2O
=> 33,2 + 1,2. 136 + 0,6.63 = (56a+ 0,3+1,2.96 +62b+1,2.39) + ( 2x.30 + 46x) + 0,75.18
=> 56a+ 62b+106x=58, 4( 3)
Từ (1), (2), (3) => a= 0,45 ; b= 0,45; x = 0,05 (mol)
Phần 2: Tác dụng với Ba(OH)2 dư
=> m↓ = mBaSO4 + mFe(OH)3 = 0,6.233 + 0,225.107 = 163,875 (g) ( Bảo toàn nguyên tố SO4 và Fe)
Dùng quy tắc đường chéo => nNO : nN2O = 2 : 1
Gọi số mol của NO và của N2O lần lượt là 2x và x (mol)
Phần 1: tác dụng với 0,45 mol NaOH → 0,1 mol Fe(OH)3
=> nOH- dùng để trung hòa H+ dư = 0,45 – 3nFe(OH)3 = 0,45 – 0,3 = 0,15 (mol)
=> nH+ dư = 0,15.2 = 0,3 (mol)
Ta có: ∑nH+ bđ = nKHSO4 + nHNO3 = 1,2 + 0,6 = 1,8 (mol)
BTNT H : => nH+ bđ = nH+ dư + 2nH2O => nH2O = ( 1,8 – 0,3)/2 = 0,75 (mol)
BTNT N : 0,6 = 2x + x + b
=> 3x + b = 0,6 (1)
BTĐT đối với các chất trong dd Y: 3a + 0,3+ 1,2 = 2.1,2 + b
=> 3a – b = 0,9 (2)
BTKL: mX + mKHSO4 + mHNO3 = mY + mZ + mH2O
=> 33,2 + 1,2. 136 + 0,6.63 = (56a+ 0,3+1,2.96 +62b+1,2.39) + ( 2x.30 + 46x) + 0,75.18
=> 56a+ 62b+106x=58, 4( 3)
Từ (1), (2), (3) => a= 0,45 ; b= 0,45; x = 0,05 (mol)
Phần 2: Tác dụng với Ba(OH)2 dư
=> m↓ = mBaSO4 + mFe(OH)3 = 0,6.233 + 0,225.107 = 163,875 (g) ( Bảo toàn nguyên tố SO4 và Fe)
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Sổ tay Hóa học 12 (chương trình mới) ( 18.000₫ )
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- Sổ tay lớp 12 các môn Toán, Lí, Hóa, Văn, Sử, Địa, KTPL (chương trình mới) ( 36.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1
A. 1,6 gam
B. 3,2 gam
C. 6,4 gam
D. 12,8 gam
Lời giải
Chọn đáp án A
![]()
![]()
Do sau phản ứng thu được m gam chất rắn( chính là Cu) nên Fe chỉ tạo muối Fe2+
3Fe + 2NO3- + 8H+ → 3Fe2+ + 2NO↑+ 4H2O (1)
0,075 ← 0,2 (mol)
=> Sau phản ứng (1) số mol Fe dư là 0,1 – 0,075 = 0,025 (mol)
Fe + Cu2+ → Fe2+ + Cu↓
0,025 → 0,025 → 0,025 (mol)
m↓ = mCu = 0,025.64 = 1,6 (g) => chọn A
Ghi nhớ: NO3- trong môi trường H+ có tính oxi hóa như axit HNO3
Lời giải
Đáp án A
Chú ý: Al, Fe, Cr bị thụ động trong HNO3 đặc nguội.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
A. 2,39%.
B. 3,12%.
C. 4,20%.
D. 5,64%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
A. 100ml.
B. 200ml.
C. 300ml.
D. 400ml.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. Thành phần chính của gỉ sắt là Fe3O4. xH2O.
B. Thành phần chính của gỉ đồng là Cu(OH)2. CuCO3.
C. Các đồ dùng bằng sắt thường bị ăn mòn do không được chế tạo từ Fe tinh khiết mà thường có lẫn các tạp chất khác.
D. Trong quá trình tạo thành gỉ Fe, ở catot xảy ra quá trình O2 + 2H2O + 4e → 4OH-
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Dương Nguyễn Thái
Cho em hỏi ở P1 tìm được nfe(oh)3 sao ko suy được nFe3+ ạ?
Xem tất cả 1 phản hồi
trogiangvietjack
Mình bảo toàn nguyên tố Fe là được