Cho 47,04 lít SO3(đktc) hấp thụ hết vào 90 gam dung dịch H2SO498%, thu được oleum có công thức H2SO4.nSO3. Hãy xác định công thức của oleum.
Câu hỏi trong đề: Bộ 7 Đề thi Học kì 2 Hóa 10 cực hay có đáp án !!
Quảng cáo
Trả lời:
Có \({n_{S{O_3}}} = \frac{{47,04}}{{22,4}}\)= 2,1 mol
90g dung dịch H2SO498% có:
\({m_{{H_2}S{O_4}}}\)= \[\frac{{90.98}}{{100}}\] = 88,2g → \({n_{{H_2}S{O_4}}}\)= 0,9mol
\({m_{{H_2}O}}\)= 90 - 88,2 = 1,8g → \({n_{{H_2}O}}\) = 0,1mol
Phương trình hóa học:
Ta thấy: \({n_{{H_2}S{O_4}}}:{n_{S{O_3}}} = 1:2\) suy ra n = 2.
Vậy công thức của oleum là: H2SO4.2SO3
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
a) - Lỗ rỗng của viên than tổ ong có tác dụng tăng diện tích tiếp xúc giữa than và oxi không khí
- Trong quá trình sử dụng muốn giảm nhiệt độ của than hay kéo dài thời gian, người ta thường khép bớt cửa lò lại để giảm bớt nồng độ oxi không khí.
b) Hũ sữa chua cái trong quy trình trên đóng vai trò làm chất xúc tác.
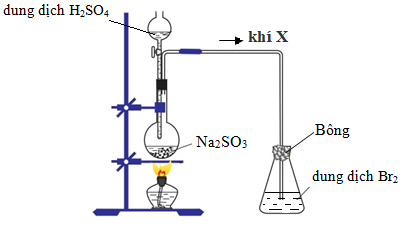
Lời giải
a. Khí X: SO2
Phương trình hóa học xảy ra trong bình cầu:
Na2SO3+ H2SO4Na2SO4+ SO2↑ + H2O
b. Hiện tượng xảy ra ở bình tam giác: dd brom bị mất màu.
Phương trình hóa học minh họa:
SO2+ Br2+ 2H2O → H2SO4+ 2HBr
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.