Theo dõi mô tả thí nghiệm chlorine phản ứng với hydrogen như dưới đây.
Hoặc quan sát video thí nghiệm theo đường link sau:
https://www.youtube.com/wach?v=esGk1lh1Nds, truy cập ngày 30/3/2022.
- Các dụng cụ thí nghiệm được mô tả như Hình 17.1a với các ống nghiệm cùng đặt vào một giá thí nghiệm.
- Bơm vài giọt dung dịch hydrochloric acid (HCl) đặc từ xilanh chứa acid vào ống nghiệm chứa tinh thể potassium permanganate (thuốc tím, KMnO4) - ống nghiệm (1) để tạo khí chlorine. Khi pit-tông nâng lên khoảng chiều cao của xi-lanh thu khí thì ngừng bơm acid (hình 17.1b)
- Rút xi-lanh thu khí ra khỏi ống nghiệm (1), chuyển sang ghim vào ống nghiệm chứa kẽm - ống nghiệm (2). Chuyển xi-lanh chứa dung dịch hydrochloric acid sang ống nghiệm (2). (Hình 17.1b)
- Bơm vài giọt dung dịch hydrochloric acid từ xi-lanh chứa acid vào ống nghiệm (2) để tạo khí hydrogen. Đến khi pit-tông được nâng lên khoảng xi-lanh thu khí thì ngừng bơm acid. (Hình 17.1c)
- Rút xi-lanh thu khí ra khỏi ống nghiệm (2). Ghim xi-lanh chứa hỗn hợp khí vào một nút cao su như hình 17.1d rồi kẹp vào giá thí nghiệm.
- Dùng đèn tử ngoại chiếu vào xi-lanh chứa hỗn hợp khí (hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi-lanh.
+ Quan sát và giải thích hiện tượng xảy ra khi dùng đèn tử ngoại chiếu vào xi-lanh chứa hỗn hợp khí (hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi-lanh)
+ Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen có thể xảy ra hiện tượng như đã thấy trong thí nghiệm trên không? Giải thích.
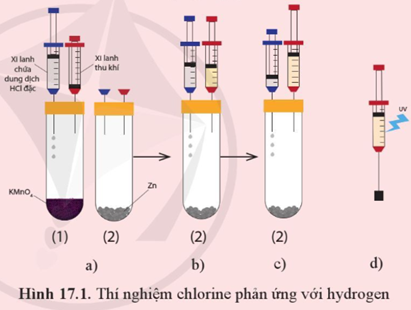
Theo dõi mô tả thí nghiệm chlorine phản ứng với hydrogen như dưới đây.
Hoặc quan sát video thí nghiệm theo đường link sau:
https://www.youtube.com/wach?v=esGk1lh1Nds, truy cập ngày 30/3/2022.
- Các dụng cụ thí nghiệm được mô tả như Hình 17.1a với các ống nghiệm cùng đặt vào một giá thí nghiệm.
- Bơm vài giọt dung dịch hydrochloric acid (HCl) đặc từ xilanh chứa acid vào ống nghiệm chứa tinh thể potassium permanganate (thuốc tím, KMnO4) - ống nghiệm (1) để tạo khí chlorine. Khi pit-tông nâng lên khoảng chiều cao của xi-lanh thu khí thì ngừng bơm acid (hình 17.1b)
- Rút xi-lanh thu khí ra khỏi ống nghiệm (1), chuyển sang ghim vào ống nghiệm chứa kẽm - ống nghiệm (2). Chuyển xi-lanh chứa dung dịch hydrochloric acid sang ống nghiệm (2). (Hình 17.1b)
- Bơm vài giọt dung dịch hydrochloric acid từ xi-lanh chứa acid vào ống nghiệm (2) để tạo khí hydrogen. Đến khi pit-tông được nâng lên khoảng xi-lanh thu khí thì ngừng bơm acid. (Hình 17.1c)
- Rút xi-lanh thu khí ra khỏi ống nghiệm (2). Ghim xi-lanh chứa hỗn hợp khí vào một nút cao su như hình 17.1d rồi kẹp vào giá thí nghiệm.
- Dùng đèn tử ngoại chiếu vào xi-lanh chứa hỗn hợp khí (hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi-lanh.
+ Quan sát và giải thích hiện tượng xảy ra khi dùng đèn tử ngoại chiếu vào xi-lanh chứa hỗn hợp khí (hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi-lanh)
+ Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen có thể xảy ra hiện tượng như đã thấy trong thí nghiệm trên không? Giải thích.

Câu hỏi trong đề: Bài tập Nguyên tố và đơn chất halogen có đáp án !!
Quảng cáo
Trả lời:
+ Khi dùng đèn tử ngoại chiếu vào xi-lanh chứa hỗn hợp khí (hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi-lanh)
Hiện tượng: Có tiếng nổ trong xi-lanh, màu vàng lục của khí Cl2 biến mất, xuất hiện khói trắng đục.
Giải thích: Khi có đèn tử ngoại chiếu vào xi-lanh (hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi-lanh) khí H2 đã xảy ra phản ứng với khí Cl2 (có màu vàng lục) tạo khói trắng đục chính là khí HCl.
Phương trình hóa học của phản ứng:
H2(g) + Cl2(g) → 2HCl(g)
+ Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen không có tiếng nổ như phản ứng của khí chlorine với hydrogen. Bên cạnh đó khi có đèn tử ngoại chiếu vào phản ứng không xảy ra mà cần dùng ngọn lửa hơ bên ngoài xi-lanh phản ứng mới xảy ra. Do tính oxi hóa của iodine yếu hơn tính oxi hóa của chlorine
Phản ứng giữa hơi iodine và hydrogen là phản ứng thuận nghịch. Cần đun nóng để phản ứng diễn ra. Sản phẩm là hỗn hợp gồm HI sinh ra và lượng H2, I2 còn lại.
Phương trình hóa học: H2 + I2 ⇄ 2HI
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
a) A là NaOH
X là H2
Y là Cl2
- Từ phản ứng giữa Y (Cl2) với dung dịch A (NaOH) sẽ sản xuất được hỗn hợp tẩy rửa phổ biến là nước Javel
Cl2(aq) + 2NaOH(aq) → NaCl(aq) + NaClO(aq) + H2O(l)
- Từ phản ứng kết hợp giữa X (H2) và Y (Cl2) sẽ sản xuất được hydrogen chloride (HCl).
H2(g) + Cl2(g) → 2HCl(g)
b) 2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + H2(g) + Cl2(g) (*)
Lời giải
Thí nghiệm 1: Khi cho nước chlorine (Cl2) màu vàng rất nhạt vào dung dịch sodium bromide (NaBr) không màu hoặc dung dịch potassium bromide (KBr) không màu thì tạo ra dung dịch màu vàng nâu của bromine (Br2)
Phương trình hóa học:
Cl2(aq) + 2NaBr(aq) → 2NaCl(aq) + Br2(aq)
Hoặc Cl2(aq) + 2KBr(aq) → 2KCl(aq) + Br2(aq)
Thí nghiệm 2:
Hiện tượng: Khi cho nước bromine (Br2) màu vàng nâu vào dung dịch sodium iodine (NaI) không màu hoặc potassium iodine (KI) không màu có thêm hồ tinh bột thì thấy dung dịch màu vàng nâu chuyển sang màu xanh tím.
Giải thích: Do Br2 màu vàng nâu đã phản ứng với dung dịch NaI hoặc KI không màu để hình thành đơn chất I2 được tinh bột hấp thụ tạo dung dịch có màu xanh tím.
Phương trình hóa học: Br2(aq) + 2NaI(aq) → 2NaBr(aq) + I2(s)
Hoặc Br2(aq) + 2KI(aq) → 2KBr(aq) + I2(s)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.