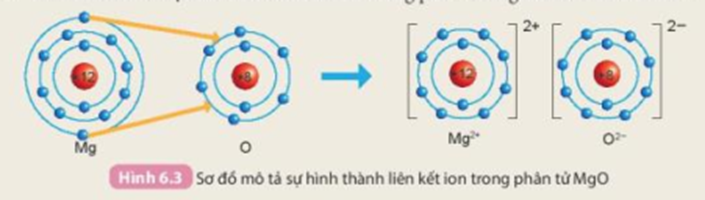
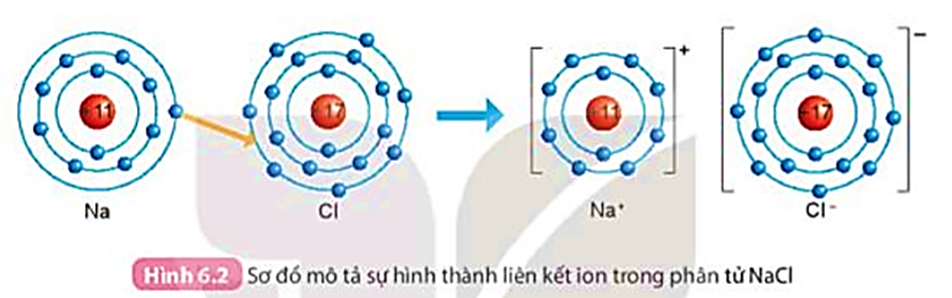
Trong tự nhiên, chỉ có các khí hiếm tồn tại ở dạng đơn nguyên tử bền vững, còn nguyên tử của các nguyên tố khác thường có xu hướng kết hợp với nhau bằng các liên kết hóa học. Các liên kết hóa học được hình thành như thế nào?
Trong tự nhiên, chỉ có các khí hiếm tồn tại ở dạng đơn nguyên tử bền vững, còn nguyên tử của các nguyên tố khác thường có xu hướng kết hợp với nhau bằng các liên kết hóa học. Các liên kết hóa học được hình thành như thế nào?
Câu hỏi trong đề: Bài tập Giới thiệu về liên kết hóa học có đáp án !!
Quảng cáo
Trả lời:
Nguyên tử của các nguyên tố khác khí hiếm có xu hướng tham gia liên kết hóa học để đạt được lớp electron ngoài cùng giống khí hiếm bằng cách nhường, nhận hay dùng chung các electron. Liên kết hóa học gồm có:
- Liên kết ion được hình thành bởi lực hút giữa các ion mang điện tích trái dấu.
- Liên kết cộng hóa trị được tạo nên do sự dùng chung một hay nhiều cặp electron.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
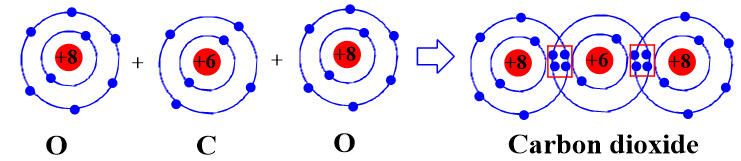
- Sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide
Khi hình thành phân tử carbon dioxide, hai nguyên tử O đã liên kết với một nguyên tử C bằng cách nguyên tử C đã góp chung với mỗi nguyên tử O hai electron tạo thành 2 cặp electron dùng chung.
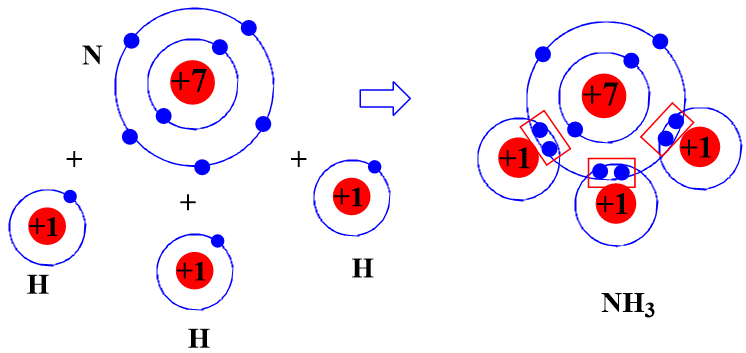
- Sự hình thành liên kết cộng hóa trị trong phân tử ammonia
Khi hình thành phân tử ammonia, ba nguyên tử H đã liên kết với một nguyên tử N bằng cách nguyên tử N đã góp chung với mỗi nguyên tử H một electron tạo thành cặp electron dùng chung.
Lời giải
- Muối ăn là hợp chất ion nên là chất rắn ở điều kiện thường, khó bay hơi, khó nóng chảy.
- Đường ăn và nước đá là hợp chất cộng hóa trị nên ở thể rắn, dễ nóng chảy và nước ở thể lỏng sẽ dễ bay hơi do các chất cộng hóa trị thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.