Hydrogen peroxide phân huỷ theo phản ứng:
2H2O2 → 2H2O + O2.
Đo thể tích oxygen thu được theo thời gian, kết quả được ghi trong bảng sau:
Thời gian (min)
0
15
30
45
60
Thể tích khí oxygen (cm3)
0
16
30
40
48
a) Vẽ đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian.
b) Tính tốc độ trung bình của phản ứng (theo cm3/min) trong các khoảng thời gian:
- Từ 0 ÷ 15 phút; - Từ 15 ÷ 30 phút;
- Từ 30 ÷ 45 phút; - Từ 45 ÷ 60 phút.
Nhận xét sự thay đổi tốc độ trung bình theo thời gian.
Hydrogen peroxide phân huỷ theo phản ứng:
2H2O2 → 2H2O + O2.
Đo thể tích oxygen thu được theo thời gian, kết quả được ghi trong bảng sau:
|
Thời gian (min) |
0 |
15 |
30 |
45 |
60 |
|
Thể tích khí oxygen (cm3) |
0 |
16 |
30 |
40 |
48 |
a) Vẽ đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian.
b) Tính tốc độ trung bình của phản ứng (theo cm3/min) trong các khoảng thời gian:
- Từ 0 ÷ 15 phút; - Từ 15 ÷ 30 phút;
- Từ 30 ÷ 45 phút; - Từ 45 ÷ 60 phút.
Nhận xét sự thay đổi tốc độ trung bình theo thời gian.
Câu hỏi trong đề: Bài tập Ôn tập chương 6 có đáp án !!
Quảng cáo
Trả lời:
a) Đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian
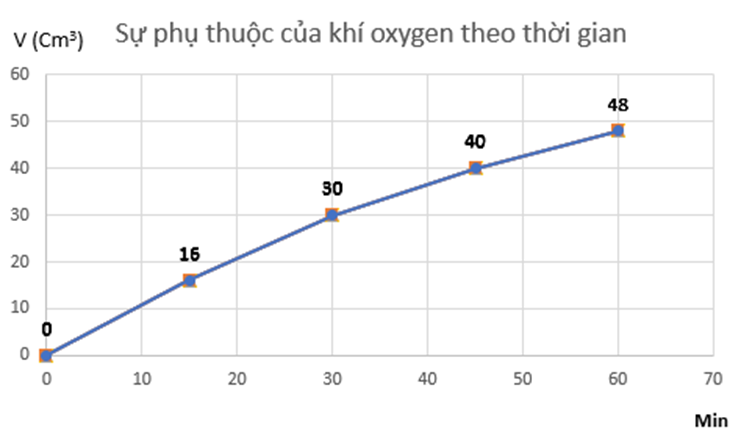
b) Tốc độ trung bình của phản ứng từ 0 ÷ 15 phút là:
cm3/min
Tốc độ trung bình của phản ứng từ 15 ÷ 30 phút là:
Tốc độ trung bình của phản ứng từ 30 ÷ 45 phút là: cm3/min
Tốc độ trung bình của phản ứng từ 45 ÷ 60 phút là: cm3/min
⇒ Tốc độ trung bình giảm dần theo thời gian.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
(a) Khi thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều thì tốc độ phản ứng tăng lên do tăng diện tích tiếp xúc của Zn.
(b) Khi thay dung dịch H2SO4 2 M bằng dung dịch H2SO4 1 M có cùng thể tích thì tốc độ phản ứng giảm do nồng độ acid giảm.
(c) Khi thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50 °C) thì tốc độ phản ứng tăng lên do số lần va chạm hiệu quả tăng.
Lời giải
(a) Đốt cháy nhiên liệu: xảy ra với tốc độ nhanh.
(b) Sắt bị gỉ: xảy ra với tốc độ chậm.
(c) Trung hòa acid – base: xảy ra với tốc độ nhanhLời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.