Viết các công thức Lewis cho mỗi phân tử sau:
a) Cl2; N2.
b) SO2; SO3.
c) H2O; H2S; HOCl.
Viết các công thức Lewis cho mỗi phân tử sau:
a) Cl2; N2.
b) SO2; SO3.
c) H2O; H2S; HOCl.
Câu hỏi trong đề: Bài tập Liên kết hóa học có đáp án !!
Quảng cáo
Trả lời:
Trả lời:
a) Công thức Lewis của Cl2 là:
Bước 1. Số electron hóa trị là 2.7 = 14 electron
Bước 2. Trong phân tử Cl2, mỗi nguyên tử Cl cần 1 electron để đạt octet.
Cl – Cl
Bước 3. Mỗi nguyên tử Cl cần 6 electron hóa trị để đạt octet:
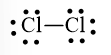
Bước 4. Số electron hóa trị còn lại là: 14 – 6.2 – 2.1 = 0
Cả hai nguyên tử Cl đều đạt octet nên công thức Lewis của Cl2 là:
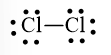
Công thức Lewis của N2 là:
Bước 1. Số electron hóa trị là 5.2 = 10 electron
Bước 2. Trong phân tử N2, mỗi nguyên tử N cần 3 electron để đạt octet.
N – N
Bước 3. Mỗi nguyên tử N cần 6 electron hóa trị để đạt octet:
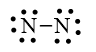
Bước 4. Số electron hóa trị còn lại là: 10 – 6.2 – 2.1 = - 4
- Số electron hóa trị của nguyên tử N là 5, nên để đạt octet mỗi nguyên tử N sẽ góp chung 3 electron hóa trị để tạo liên kết với nhau.
Công thức Lewis của phân tử N2 là
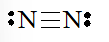
b) Công thức Lewis của SO2 là:
Số electron hóa trị là 1.6 + 2.6 = 18 electron.
Trong phân tử SO2, nguyên tử S cần 2 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vì vậy, S là nguyên tử trung tâm, còn nguyên tử O được xếp xung quanh: O – S – O.
Hoàn thiện octet cho nguyên tử O:
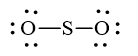
Số electron hóa trị còn lại: 18 – 2.2 – 2.6 = 2
Sử dụng 2 electron này để tạo octet cho S.
Nguyên tử S có 4 electron hóa trị nên 1 nguyên tử O sẽ dùng 1 cặp electron để tạo liên kết với S và nguyên tử S còn 1 đôi electron chưa tham gia liên kết.
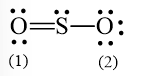
Công thức Lewis của SO3 là:
- Viết công thức Lewis của SO3
Bước 1: S có 6 electron hóa trị, O có 6 electron hóa trị. Trong phân tử SO3, có 1 nguyên tử S và 3 nguyên tử O
⇒ Tổng số electron hóa trị = 1.6 + 3.6 = 24 electron
Bước 2: Vẽ khung tạo bởi các nguyên tử liên kết với nhau:
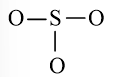
Bước 3: Mỗi nguyên tử O cần 6 electron để đạt octet.
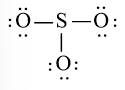
Bước 4: Số electron hóa trị còn lại là: 24 – 2.3 – 6.3 = 0
Tuy nhiên S chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O tạo thành cặp electron dùng chung.
chung.
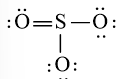 hoặc
hoặc 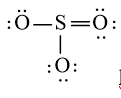 hoặc
hoặc 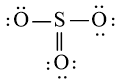
c) Công thức Lewis của H2O là:
Bước 1. Tổng số electron hóa trị là 1.2 + 1.6 = 8
Bước 2. Trong phân tử H2O, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron hóa trị để đạt octet. Vì vậy, O là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh. H – O – H.
Bước 3. Nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại là: 8 – 2.2 = 4
Nguyên tử O có 4 electron hóa trị nên sẽ chuyển 4 electron còn lại cho O để nguyên tử O đạt octet.
Công thức Lewis của H2O là:
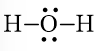
Công thức Lewis của H2S là:
Bước 1. Tổng số electron hóa trị của phân tử = 1.2 + 1.6 = 8 electron
Bước 2. Trong phân tử H2S, nguyên tử S cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, nguyên tử S là nguyên tử trung tâm, còn 2 nguyên tử H được xếp xung quanh: H – S – H
Bước 3. 2 nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại = 8 – 2.2 = 4
Nguyên tử S có 4 electron hóa trị nên để đạt octet thì chuyển 4 electron còn lại cho nguyên tử S.
Công thức Lewis của H2S là:
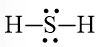
Công thức Lewis của HOCl là:
Bước 1. Tổng số electron hóa trị của phân tử = 1.1 + 1.6 + 1.7 = 14 electron.
Bước 2. Trong phân tử HOCl, nguyên tử Cl cần 1 electron để đạt octet, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, O là nguyên tử trung tâm, nguyên tử H và Cl được xếp xung quang: H – O – Cl
Bước 3. Nguyên tử H đã đạt octet, nguyên tử Cl cần 7 electron hóa trị để đạt octet:
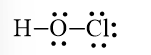
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Trả lời:
Đáp án đúng là: C
Bước 1: Tổng số electron hóa trị trong phân tử = 1.5 + 2.6 = 17 electron
Bước 2: Trong phân tử NO2, nguyên tử N cần 3 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử O được xếp xung quanh: O – N – O
Bước 3: Mỗi nguyên tử O cần 6 electron hóa trị để đạt octet:
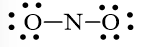
Bước 4: Số electron hóa trị còn lại là 17 – 6.2 – 2.2 = 1
Mà nguyên tử N chưa đạt octet nên 1 nguyên tử O sẽ dùng 1 cặp electron hóa trị để tạo liên kết với nguyên tử N và trên nguyên tử N vẫn còn 1 electron chưa tham gia liên kết.
Công thức Lewis của NO2 là
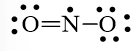 hoặc
hoặc 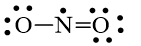
Lời giải
Trả lời:
Mô hình VSEPR được sử dụng để mô tả dạng hình học của các phân tử dựa trên lực đẩy giữa các cặp electron hóa trị. Để sử dụng mô hình VSEPR, công thức phân tử của chất được viết dưới dạng AXnEm. Trong đó:
A: nguyên tử trung tâm;
X: nguyên tử liên kết với nguyên tử A; n là số nguyên tử;
E: cặp electron hóa trị chưa liên kết của nguyên tử A; m là số cặp electron;
Lưu ý: Nếu nguyên tử trung tâm lẻ một electron thì electron đó vẫn được tính tương đương một cặp electron.
+ Trường hợp AXn (với n = 2, 3, 4, …)
• Với n = 2, phân tử có cấu trúc thẳng.
• Với n = 3, phân tử có cấu trúc tam giác phẳng.
• Với n = 4, phân tử có cấu trúc tứ diện.
+ Trường hợp AXnEm
• Với dạng AX2E, phân tử có dạng góc.
• Với dạng AX3E, phân tử có dạng tháp tam giác.
• Với dạng AX2E2, phân tử có dạng góc.
Có một số trường hợp mô hình VSEPR không giải thích được hình dạng phân tử nhưng có thể giải thích theo sự lai hóa orbital nguyên tử như CH4, NF3, …
Có 3 trạng thái lai hóa cơ bản: lai hóa sp3, lai hóa sp2 và lai hóa sp.Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.