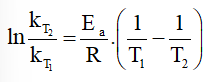Một phản ứng xảy ra ở 500°C, năng lượng hoạt hóa của phản ứng khi không có xúc tác và khi có xúc tác lần lượt là 55,4 kJ/mol và 13,5 kJ/mol. Chứng minh rằng chất xúc tác có ảnh hưởng đến tốc độ phản ứng.
Một phản ứng xảy ra ở 500°C, năng lượng hoạt hóa của phản ứng khi không có xúc tác và khi có xúc tác lần lượt là 55,4 kJ/mol và 13,5 kJ/mol. Chứng minh rằng chất xúc tác có ảnh hưởng đến tốc độ phản ứng.
Câu hỏi trong đề: Bài tập Năng lượng hoạt hóa của phản ứng hóa học có đáp án !!
Quảng cáo
Trả lời:
Trả lời:
Ta thấy: Năng lượng hoạt hóa của phản ứng khi không có xúc tác là 55,4 kJ/mol lớn hơn rất nhiều so với năng lượng hoạt hóa của phản ứng khi có xúc tác là 13,5 kJ/mol.
⇒ Khi có chất xúc tác sẽ làm giảm năng lượng hoạt hóa của phản ứng nên làm tăng tốc độ phản ứng
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Trả lời:
Khi nhiệt độ tăng từ 300 K lên 310 K thì tốc độ phản ứng tăng 3 lần.
⇒
Mà ⇒
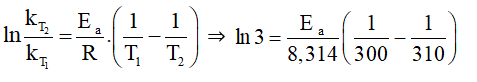
⇒ Ea = 84 944,92 J/mol ≈ 85 kJ/mol
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.