Vận dụng kiến thức về cân bằng hoá học, tốc độ phản ứng, biến thiên enthalpy để giải thích các điều kiện của phản ứng sản xuất ammonia, cụ thể:
1. Nếu tăng hoặc giảm nhiệt độ sẽ ảnh hưởng đến sự chuyển dịch cân bằng và tốc độ phản ứng như thế nào?
2. Nếu giảm áp suất, cân bằng chuyển dịch theo chiều nào? Tại sao không thực hiện ở áp suất cao hơn?
3. Vai trò của chất xúc tác trong phản ứng là gì?
Vận dụng kiến thức về cân bằng hoá học, tốc độ phản ứng, biến thiên enthalpy để giải thích các điều kiện của phản ứng sản xuất ammonia, cụ thể:
1. Nếu tăng hoặc giảm nhiệt độ sẽ ảnh hưởng đến sự chuyển dịch cân bằng và tốc độ phản ứng như thế nào?
2. Nếu giảm áp suất, cân bằng chuyển dịch theo chiều nào? Tại sao không thực hiện ở áp suất cao hơn?
3. Vai trò của chất xúc tác trong phản ứng là gì?
Quảng cáo
Trả lời:
Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ 400 oC – 450 oC, áp suất 150 – 200 bar, xúc tác Fe.
1) Vì DrHo = -91,8 kJ < 0 nên phản ứng thuận toả nhiệt. Vậy:
+ Nếu tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch (tức chiều phản ứng thu nhiệt) làm giảm hiệu suất phản ứng.
+ Nếu giảm nhiệt độ, cân bằng chuyển dịch theo chiều thuận (tức chiều phản ứng toả nhiệt) làm tăng hiệu suất phản ứng.
Tuy nhiên, khi thực hiện phản ứng ở nhiệt độ quá thấp thì tốc độ của phản ứng nhỏ, phản ứng diễn ra chậm. Thực tế, người ta đã chọn nhiệt độ phù hợp, khoảng 400 oC - 450 oC.
2. Khi giảm áp suất, cân bằng chuyển dịch theo chiều làm tăng áp suất của hệ - tức chiều làm tăng số mol khí, hay chiều nghịch.
Quá trình sản xuất NH3 được thực hiện ở áp suất 150 – 200 bar mà không thực hiện ở áp suất cao hơn. Điều này được giải thích như sau: Khi thực hiện ở áp suất cao sẽ thu
được nồng độ NH3 tại thời điểm cân bằng lớn, tuy nhiên khi tăng áp suất thì
sự tăng nồng độ NH3 không tăng nhanh chỉ tăng chậm. Ngoài ra, khi tăng áp suất thì
tiêu tốn năng lượng và yêu cầu thiết bị phải chịu được áp suất cao, do đó phải
tính toán chính xác khi tăng áp suất để mang lại hiệu quả kinh tế cao nhất. Thực tế chứng minh quá trình sản xuất NH3 được thực hiện ở áp suất 150 – 200 bar đem lại hiệu quả cao nhất.
3. Việc sử dụng chất xúc tác là bột sắt có tác dụng làm cho phản ứng nhanh đạt tới trạng thái cân bằng.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Hóa học 11 dùng cho cả 3 bộ sách Kết nối, Cánh diều, Chân trời sáng tạo VietJack - Sách 2025 ( 58.000₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 11 VietJack - Sách 2025 theo chương trình mới cho 2k8 ( 45.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Xét phản ứng: NH3 + HCl → NH4Cl
Chất cho proton là HCl, chất nhận proton là NH3:
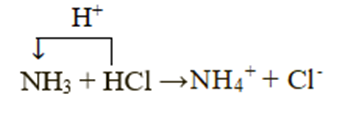
Xét phản ứng: NH3 + HNO3 → NH4NO3
Chất cho proton là HNO3, chất nhận proton là NH3:
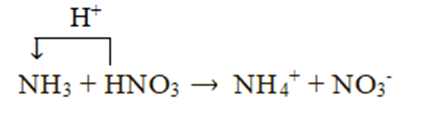
Xét phản ứng: 2NH3 + H2SO4 → (NH4)2SO4
Chất cho proton là H2SO4, chất nhận proton là NH3:
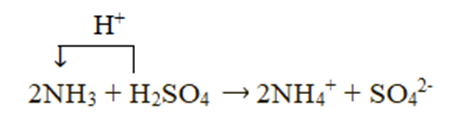
Lời giải
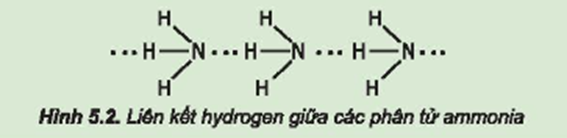
Trong phân tử nitrogen:
- Nguyên tử nitrogen còn một cặp electron không liên kết, tạo ra vùng có mật độ điện tích âm trên nguyên tử nitrogen.
- Liên kết N – H phân cực, cặp electron dùng chung lệch về phía nguyên tử nitrogen làm cho nguyên tử hydrogen mang một phần điện tích dương.
Do đó, các phân tử ammonia có khả năng tạo liên kết hydrogen mạnh với nhau.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.