Các kim loại nhóm IA (nhóm kim loại kiềm) và hợp chất của chúng có nhiều ứng dụng như: sản xuất pin lithium, nước Javel, phân kali, tế bào quang điện, đồng hồ nguyên tử,...
Vậy, đơn chất nhóm IA có đặc điểm gì nổi bật về tính chất vật lí và tính chất hoá học? Các hợp chất nhóm IA quan trọng như xút, soda được sản xuất trong công nghiệp như thế nào?

Các kim loại nhóm IA (nhóm kim loại kiềm) và hợp chất của chúng có nhiều ứng dụng như: sản xuất pin lithium, nước Javel, phân kali, tế bào quang điện, đồng hồ nguyên tử,...
Vậy, đơn chất nhóm IA có đặc điểm gì nổi bật về tính chất vật lí và tính chất hoá học? Các hợp chất nhóm IA quan trọng như xút, soda được sản xuất trong công nghiệp như thế nào?

Quảng cáo
Trả lời:
- Tính chất vật lí của đơn chất nhóm IA:
+ Trong nhóm IA, nhiệt độ nóng chảy và nhiệt độ sôi của các kim loại có xu hướng giảm dần từ Li đến Cs.
Các kim loại nhóm IA đều dễ nóng chảy và có nhiệt độ nóng chảy thấp hơn so với các kim loại nhóm khác.
+ Các kim loại nhóm IA có khối lượng riêng nhỏ (đều là kim loại nhẹ) do có bán kính nguyên tử lớn và cấu trúc mạng tinh thể kém đặc khít.
+ Do có liên kết kim loại yếu nên các kim loại nhóm IA có độ cứng thắp (đều mềm, có thể cắt bằng dao, kéo).
- Tính chất hoá học của đơn chất nhóm IA:
+ Kim loại kiềm là những kim loại hoạt động hoá học mạnh, có tính khử mạnh và tính khử tăng dần từ Li đến Cs.
+ Các kim loại kiềm có thể điện cực chuẩn rất âm, do đó chúng đều phản ứng với nước ở điều kiện thường với mức độ tăng dần từ Li đến Cs.
- Các hợp chất nhóm IA quan trọng như xút, soda được sản xuất trong công nghiệp như sau:
+ Trong công nghiệp, xút (NaOH) được điều chế bằng phương pháp điện phân dung dịch NaCl bão hoà, có màng ngăn điện cực.
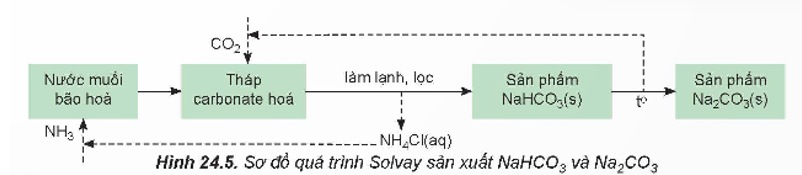
+ Trong công nghiệp, sodium hydrogencarbonate (baking soda) và sodium carbonate (soda) được sản xuất bằng phương pháp Solvay từ nguyên liệu chính là đá vôi, muối ăn, ammonia và nước.
Quá trình Solvay sản xuất soda gồm hai giai đoạn chính:
Giai đoạn tạo NaHCO3:
NaCl + NH3 + CO2 + H2O ⇌ NaHCO3 + NH4Cl
Khi làm lạnh, NaHCO3 kết tinh và được lọc, tách khỏi hệ phản ứng.
Giai đoạn tạo Na2CO3:
2NaHCO3 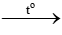 Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- Sổ tay lớp 12 các môn Toán, Lí, Hóa, Văn, Sử, Địa, KTPL (chương trình mới) ( 36.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội, TP Hồ Chí Minh (2 cuốn) ( 150.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Trong dung dịch:
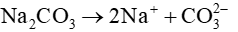
Phương trình hoá học để giải thích các ứng dụng:
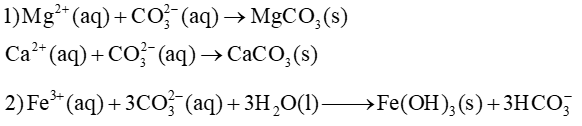
Lời giải
a) Trong quá trình Solvay viết các phương trình hoá học của phản ứng:
- Nung vôi để cung cấp vôi sống và carbon dioxide:
CaCO3 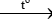 CaO + CO2
CaO + CO2
- Tái chế ammonia từ vôi sống và dung dịch ammonium chloride.
CaO + H2O → Ca(OH)2
Ca(OH)2 + 2NH4Cl → CaCl2 + 2NH3↑ + 2H2O
Hoặc có thể viết gọn:
2NH4Cl + CaO → 2NH3 + CaCl2 + H2O
b) Quy trình Solvay đã giảm thiểu được tác động đến môi trường bằng cách quay vòng các sản phẩm trung gian (như CO2 và NH3) để tái sử dụng trong quy trình sản xuất.
Từ sơ đồ quá trình Solvay, ta có quá trình cụ thể như sau:
(1) Hoà tan NaCl vào dung dịch NH3 đặc đến bão hoà.
(2) Nung CaCO3, rồi dẫn khí thoát ra vào dung dịch bão hoà của NaCl trong NH3:
CaCO3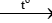 CaO + CO2
CaO + CO2
NaCl + NH3 + CO2 + H2O  NaHCO3 + NH4Cl
NaHCO3 + NH4Cl
(3) Do NaHCO3 ít tan hơn các muối khác nên kết tinh trước. Tách NaHCO3 ra khỏi dung dịch, nung ở nhiệt độ cao được soda:
2NaHCO3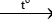 Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
(4) Sản phẩm NH4Cl được chế hoá bởi vôi tôi, thu khí NH3:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
Các khí CO2, NH3 được đưa vào sử dụng lại. NH3 được tuần hoàn trong quá trình sản xuất.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.