Lithium, sodium, potassium tác dụng với nước, chlorine, oxygen
Ba thí nghiệm về phản ứng của lithium, sodium, potassium với nước, chlorine, oxygen đã được thực hiện và quan sát thấy các hiện tượng như được mô tả dưới đây:
Hoá chất: kim loại lithium, sodium, potassium, nước.
Dụng cụ: 3 bình tam giác đựng khí oxygen, 3 bình tam giác đựng khí chlorine, 3 chậu thuỷ tinh, muôi sắt, dao, kẹp sắt.
Thí nghiệm 1: Tác dụng với nước
Tiến hành:
Cho mỗi mẩu kim loại vào một chậu thuỷ tinh chứa nước, hiện tượng xảy ra được ghi lại ở Bảng 24.3.

Thực hiện các yêu cầu sau:
1. So sánh mức độ phản ứng của Li, Na, K với nước.
2. Viết phương trình hoá học của các phản ứng xảy ra. Nêu cách nhận biết môi trường của các dung dịch sau phản ứng.
Thí nghiệm 2: Tác dụng với chlorine
Tiến hành:
Cho mỗi mẩu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy, rồi đưa nhanh vào bình đựng khí chlorine.
Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K. Thực hiện yêu cầu sau:
Viết phương trình hoá học của các phản ứng xảy ra.
Thí nghiệm 3: Tác dụng với oxygen
Tiến hành:
Cho mỗi mẩu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy rồi đưa nhanh vào lọ đựng khí oxygen.
Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K.
Thực hiện yêu cầu sau:
Viết phương trình hoá học của các phản ứng xảy ra.
Lithium, sodium, potassium tác dụng với nước, chlorine, oxygen
Ba thí nghiệm về phản ứng của lithium, sodium, potassium với nước, chlorine, oxygen đã được thực hiện và quan sát thấy các hiện tượng như được mô tả dưới đây:
Hoá chất: kim loại lithium, sodium, potassium, nước.
Dụng cụ: 3 bình tam giác đựng khí oxygen, 3 bình tam giác đựng khí chlorine, 3 chậu thuỷ tinh, muôi sắt, dao, kẹp sắt.
Thí nghiệm 1: Tác dụng với nước
Tiến hành:
Cho mỗi mẩu kim loại vào một chậu thuỷ tinh chứa nước, hiện tượng xảy ra được ghi lại ở Bảng 24.3.

Thực hiện các yêu cầu sau:
1. So sánh mức độ phản ứng của Li, Na, K với nước.
2. Viết phương trình hoá học của các phản ứng xảy ra. Nêu cách nhận biết môi trường của các dung dịch sau phản ứng.
Thí nghiệm 2: Tác dụng với chlorine
Tiến hành:
Cho mỗi mẩu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy, rồi đưa nhanh vào bình đựng khí chlorine.
Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K. Thực hiện yêu cầu sau:
Viết phương trình hoá học của các phản ứng xảy ra.
Thí nghiệm 3: Tác dụng với oxygen
Tiến hành:
Cho mỗi mẩu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy rồi đưa nhanh vào lọ đựng khí oxygen.
Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K.
Thực hiện yêu cầu sau:
Viết phương trình hoá học của các phản ứng xảy ra.
Quảng cáo
Trả lời:
Thực hiện các yêu cầu:
Thí nghiệm 1:
1. Các kim loại kiềm phản ứng mạnh với nước, mức độ phản ứng tăng dần theo chiều: Li, Na, K.
2. Phương trình hoá học của phản ứng xảy ra:
2Li + 2H2O → 2LiOH + H2
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Để nhận biết môi trường của các dung dịch sau phản ứng có thể dùng các chất chỉ thị như quỳ tím, phenolphthalein.
Thí nghiệm 2:
Các phương trình hoá học của phản ứng xảy ra:
2Li + Cl2  2LiCl
2LiCl
2Na + Cl2 2NaCl
2NaCl
2K + Cl2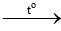 2KCl
2KCl
Thí nghiệm 3:
Các phương trình hoá học của phản ứng xảy ra:
4Li + O2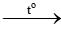 2Li2O
2Li2O
4Na + O2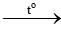 2Na2O
2Na2O
4K + O2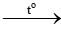 2K2O
2K2O
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- Sổ tay lớp 12 các môn Toán, Lí, Hóa, Văn, Sử, Địa, KTPL (chương trình mới) ( 36.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội, TP Hồ Chí Minh (2 cuốn) ( 150.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Trong dung dịch:
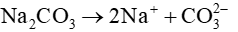
Phương trình hoá học để giải thích các ứng dụng:
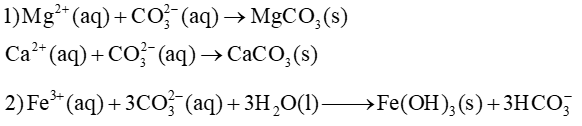
Lời giải
- Tính chất vật lí của đơn chất nhóm IA:
+ Trong nhóm IA, nhiệt độ nóng chảy và nhiệt độ sôi của các kim loại có xu hướng giảm dần từ Li đến Cs.
Các kim loại nhóm IA đều dễ nóng chảy và có nhiệt độ nóng chảy thấp hơn so với các kim loại nhóm khác.
+ Các kim loại nhóm IA có khối lượng riêng nhỏ (đều là kim loại nhẹ) do có bán kính nguyên tử lớn và cấu trúc mạng tinh thể kém đặc khít.
+ Do có liên kết kim loại yếu nên các kim loại nhóm IA có độ cứng thắp (đều mềm, có thể cắt bằng dao, kéo).
- Tính chất hoá học của đơn chất nhóm IA:
+ Kim loại kiềm là những kim loại hoạt động hoá học mạnh, có tính khử mạnh và tính khử tăng dần từ Li đến Cs.
+ Các kim loại kiềm có thể điện cực chuẩn rất âm, do đó chúng đều phản ứng với nước ở điều kiện thường với mức độ tăng dần từ Li đến Cs.
- Các hợp chất nhóm IA quan trọng như xút, soda được sản xuất trong công nghiệp như sau:
+ Trong công nghiệp, xút (NaOH) được điều chế bằng phương pháp điện phân dung dịch NaCl bão hoà, có màng ngăn điện cực.
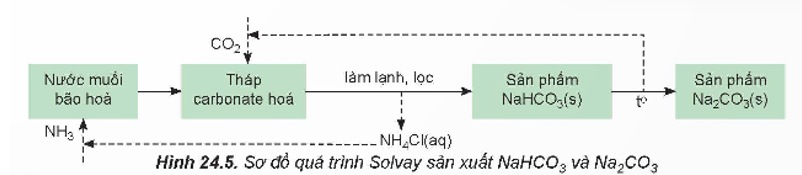
+ Trong công nghiệp, sodium hydrogencarbonate (baking soda) và sodium carbonate (soda) được sản xuất bằng phương pháp Solvay từ nguyên liệu chính là đá vôi, muối ăn, ammonia và nước.
Quá trình Solvay sản xuất soda gồm hai giai đoạn chính:
Giai đoạn tạo NaHCO3:
NaCl + NH3 + CO2 + H2O ⇌ NaHCO3 + NH4Cl
Khi làm lạnh, NaHCO3 kết tinh và được lọc, tách khỏi hệ phản ứng.
Giai đoạn tạo Na2CO3:
2NaHCO3 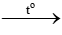 Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.