Vì sao nguyên tử N và một nguyên tử O trong anion NO2− đều có thể tạo liên kết cho – nhận với nguyên tử trung tâm như trong phức chất (III) hoặc (IV)?
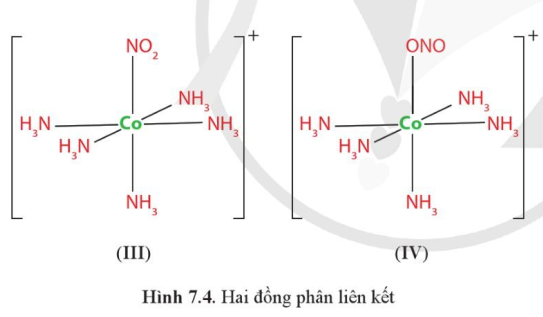
Vì sao nguyên tử N và một nguyên tử O trong anion NO2− đều có thể tạo liên kết cho – nhận với nguyên tử trung tâm như trong phức chất (III) hoặc (IV)?

Quảng cáo
Trả lời:
Nguyên tử N và một nguyên tử O trong anion NO2− đều có thể tạo liên kết cho – nhận với nguyên tử trung tâm như trong phức chất (III) hoặc (IV) vì nguyên tử N hay O trong anion NO2− đều có thể cho vào orbital trống của nguyên tử Co2+ cặp electron liên kết.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 500 Bài tập tổng ôn Hóa học (Form 2025) ( 38.000₫ )
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- Sổ tay lớp 12 các môn Toán, Lí, Hóa, Văn, Sử, Địa, KTPL (chương trình mới) ( 36.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Thuyết liên kết hóa trị giải thích dạng hình học của phức chất [Zn(NH3)4]2+ như sau:
Phức chất có điện tích là +2, mỗi phân tử NH3 trung hoà về điện (có điện tích là 0), vậy điện tích của nguyên tử trung tâm là +2.
Cấu hình electron của ion Zn2+ là: [Ar]3d104s04p0.
Cấu hình electron hoá trị dạng ô orbital của Zn2+ là:
![Thực nghiệm xác nhận phức chất [Zn(NH3)4]2+ có dạng hình học tứ diện. Giải thích sự tạo thành liên kết và mô tả cấu tạo phức chất này theo thuyết Liên kết hóa trị. (ảnh 1)](https://video.vietjack.com/upload2/quiz_source1/2024/07/blobid2-1721490302.png)
Cation Zn2+ sử dụng 1 orbital 4s trống và 3 orbital 4p trống để lai hoá sp3, tạo nên 4 orbital lai hoá trống.
Mỗi phân tử NH3 cho mỗi orbital lai hoá trống của cation Zn2+ một cặp electron chưa liên kết để hình thành một liên kết cho – nhận.
Lời giải
- Giải thích sự tạo thành liên kết trong phức chất [CoCl4]2-:
Phức chất có điện tích là -2, mỗi ion Cl− có điện tích là -1 nên điện tích của nguyên tử trung tâm là +2.
Cấu hình electron của ion Co2+ là: [Ar]3d74s04p0.
Cấu hình electron hoá trị dạng ô orbital của Co2+ là:
![Phức chất [CoCl4]2- có dạng hình học tứ diện. Giải thích sự tạo thành liên kết và vẽ dạng hình học của phức chất này theo thuyết Liên kết hóa trị. (ảnh 1)](https://video.vietjack.com/upload2/quiz_source1/2024/07/blobid8-1721490528.png)
Cation Co2+ sử dụng 1 orbital 4s trống và 3 orbital 4p trống để lai hoá sp3, tạo nên 4 orbital lai hoá trống.
Mỗi anion Cl- cho mỗi orbital lai hoá trống của cation Co2+ một cặp electron chưa liên kết để hình thành một liên kết cho – nhận.
- Dạng hình học của phức chất [CoCl4]2- theo thuyết Liên kết hóa trị:
![Phức chất [CoCl4]2- có dạng hình học tứ diện. Giải thích sự tạo thành liên kết và vẽ dạng hình học của phức chất này theo thuyết Liên kết hóa trị. (ảnh 2)](https://video.vietjack.com/upload2/quiz_source1/2024/07/blobid9-1721490530.png)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
![Chỉ ra đồng phân cis và trans của phức chất bát diện [CoCl2(NH3)4]+ ở Hình 7.3. (ảnh 1)](https://video.vietjack.com/upload2/quiz_source1/2024/07/blobid6-1721490450.png)
![Bằng thực nghiệm, người ta xác định được cấu tạo của phức chất [NiCl4]2- như hình bên. Hãy cho biết: a) Dạng hình học của phức chất. b) Thuyết liên kết hóa trị giải thích dạng hình học của phức chất [NiCl4]2- như thế nào? (ảnh 1)](https://video.vietjack.com/upload2/quiz_source1/2024/07/blobid1-1721490250.png)