Sulfuric acid (H2SO4) là hoá chất quan trọng, được sản xuất trong công nghiệp bằng phương pháp tiếp xúc qua ba giai đoạn:
(1) S(s) + 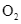 (g) →
(g) → 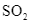 (g)
(g)
(2) 2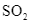 (g) +
(g) + 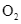 (g)
(g)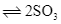 (g)
(g) 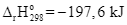
(3) n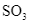 (g) +
(g) + 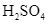 (aq) →
(aq) → 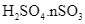 (l)
(l)
a. Ở giai đoạn (2), khi giảm nhiệt độ thì cân bằng dịch chuyển về phía tạo thành SO3.
b. Ở giai đoạn (2), cần dùng xúc tác để cân bằng chuyển dịch sang phải, giảm lượng SO2 trong khí thải.
c. Nhiệt độ ở giai đoạn (2) không được quá thấp vì ảnh hưởng đến tốc độ phản ứng.
d. Ở giai đoạn (3), người ta dùng nước cất hấp thụ trực tiếp SO3 để thu dung dịch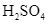 loãng.
loãng.
Sulfuric acid (H2SO4) là hoá chất quan trọng, được sản xuất trong công nghiệp bằng phương pháp tiếp xúc qua ba giai đoạn:
(1) S(s) + ![]() (g) →
(g) → ![]() (g)
(g)
(2) 2![]() (g) +
(g) + ![]() (g)
(g)![]() (g)
(g) ![]()
(3) n![]() (g) +
(g) + ![]() (aq) →
(aq) → ![]() (l)
(l)
a. Ở giai đoạn (2), khi giảm nhiệt độ thì cân bằng dịch chuyển về phía tạo thành SO3.
b. Ở giai đoạn (2), cần dùng xúc tác để cân bằng chuyển dịch sang phải, giảm lượng SO2 trong khí thải.
c. Nhiệt độ ở giai đoạn (2) không được quá thấp vì ảnh hưởng đến tốc độ phản ứng.
d. Ở giai đoạn (3), người ta dùng nước cất hấp thụ trực tiếp SO3 để thu dung dịch![]() loãng.
loãng.
Câu hỏi trong đề: 28 bài tập Cân bằng hoá học có đáp án !!
Quảng cáo
Trả lời:
|
a |
Đ |
|
b |
S |
|
c |
Đ |
|
d |
S |
Ta có: ![]() nên chiều thuận phản ứng (2) là phản ứng tỏa nhiệt.
nên chiều thuận phản ứng (2) là phản ứng tỏa nhiệt.
a. Đúng. Khi giảm nhiệt độ cân bằng dịch chuyển theo chiều phản ứng tỏa nhiệt, tức là chiều tạo thành ![]()
b. Sai. Vì chất xúc tác làm tăng tốc độ phản ứng, không làm cân bằng hóa học chuyển dịch.
c. Đúng.
d. Sai. Ở giai đoạn (3), người ta dùng H2SO4 đặc hấp thụ trực tiếp SO3 để thu được oleum.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Sổ tay Hóa học 12 (chương trình mới) ( 18.000₫ )
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- Tổng ôn lớp 12 môn Toán, Lí, Hóa, Văn, Anh, Sinh Sử, Địa, KTPL (Form 2025) ( 36.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Chọn C
![]()
![]()
H2 (g) + I2 (g) ![]() 2HI (g)
2HI (g)
Bđ: 0,2 0,16 M
Pư: x x 2x M
Cb: 0,2-x 0,16-x 2x M
⇒ 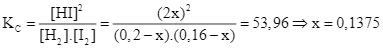
⇒ [HI]= 2x = 0,275M
Lời giải
Chọn B
Các phát biểu đúng bao gồm : 1, 3, 4.
(2) Sai vì cân bằng hóa học là cân bằng động.
(5) Sai vì khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng tiếp tục xảy ra với tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
(6) Sai vì cân bằng hóa học là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Câu 3
Khi tìm hiểu về các yếu tố ảnh hưởng đến tốc độ phản ứng, để trả lời cho câu hỏi “Nồng độ chất tham gia ảnh hưởng đến tốc độ phản ứng như thế nào?”, một học sinh đã tiến hành thí nghiệm theo các bước:
Bước 1: Chuẩn bị 2 cốc thuỷ tinh 250 mL được đánh dấu A và B.
Bước 2: Rót 50 mL dung dịch hydrochloric acid (HCl) 1M vào cốc A; 50 mL dung dịch HCl 2M vào cốc B.
Bước 3: Cho 1 gam bột kẽm (Zn) vào mỗi cốc. Quan sát hiện tượng xảy ra ở 2 cốc.
a. Nếu trong cùng một khoảng thời gian, lượng khí thoát ra ở cốc nào nhiều hơn thì có thể kết luận tốc độ phản ứng ở cốc đó lớn hơn cốc còn lại.
b. Ở bước 3, nếu cho 1 gam Zn dạng viên vào cốc A, 1 gam bột Zn vào cốc B thì có thể cho thấy được tốc độ phản ứng phụ thuộc vào nồng độ.
c. “Tốc độ phản ứng không phụ thuộc vào nồng độ chất tham gia” có thể là một giả thuyết tương ứng với câu hỏi trên.
d. Ở bước 3, nếu sử dụng bột đồng (Cu) thay cho bột Zn thì thí nghiệm không còn phù hợp để trả lời câu hỏi trên.
Khi tìm hiểu về các yếu tố ảnh hưởng đến tốc độ phản ứng, để trả lời cho câu hỏi “Nồng độ chất tham gia ảnh hưởng đến tốc độ phản ứng như thế nào?”, một học sinh đã tiến hành thí nghiệm theo các bước:
Bước 1: Chuẩn bị 2 cốc thuỷ tinh 250 mL được đánh dấu A và B.
Bước 2: Rót 50 mL dung dịch hydrochloric acid (HCl) 1M vào cốc A; 50 mL dung dịch HCl 2M vào cốc B.
Bước 3: Cho 1 gam bột kẽm (Zn) vào mỗi cốc. Quan sát hiện tượng xảy ra ở 2 cốc.
a. Nếu trong cùng một khoảng thời gian, lượng khí thoát ra ở cốc nào nhiều hơn thì có thể kết luận tốc độ phản ứng ở cốc đó lớn hơn cốc còn lại.
b. Ở bước 3, nếu cho 1 gam Zn dạng viên vào cốc A, 1 gam bột Zn vào cốc B thì có thể cho thấy được tốc độ phản ứng phụ thuộc vào nồng độ.
c. “Tốc độ phản ứng không phụ thuộc vào nồng độ chất tham gia” có thể là một giả thuyết tương ứng với câu hỏi trên.
d. Ở bước 3, nếu sử dụng bột đồng (Cu) thay cho bột Zn thì thí nghiệm không còn phù hợp để trả lời câu hỏi trên.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.