Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 103 đến 105:
Trong chất rắn và lỏng: các phân tử bị giữ với nhau bởi lực hút liên phân tử. Các lực này đóng vai trò quan trọng trong việc tạo thành dung dịch.
Trong dung dịch thường có 3 loại tương tác:
1. Phân tử chất tan với chất tan.
2. Dung môi với dung môi.
3. Dung môi với chất tan.
Để đơn giản ta có thể hình dung quá trình hòa tan gồm ba giai đoạn sau:
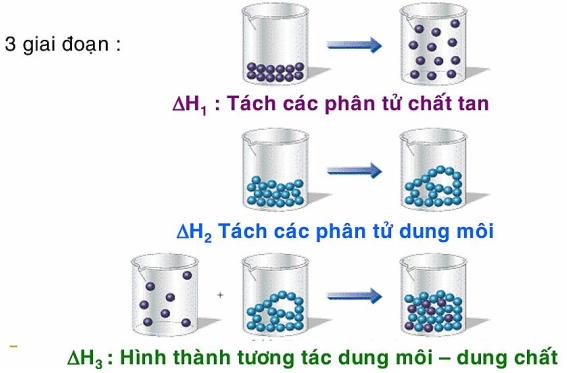
Quá trình hòa tan ứng với 3 giai đoạn xảy ra đồng thời ứng với các quá trình biến đổi năng lượng
sau:
1. Tách các phân tử chất tan (DH1 ).
2. Tách các phân tử dung môi (DH2 ).
3. Quá trình solvat hóa (DH3).
Biến thiên enthalpy (nhiệt hòa tan - DHht) của quá trình hòa tan tính như sau:
. DHht có thể âm hay dương tùy thuộc vào tương quan giữa các lực liên phân tử: chất tan với chất tan, dung môi với dung môi và chất tan với dung môi. Quá trình tương tác giữa các phân tử dung môi với phân tử chất tan gọi là solvat hóa (dung môi hóa). Nếu dung môi là nước còn gọi là hydrat hóa.
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 103 đến 105:
Trong chất rắn và lỏng: các phân tử bị giữ với nhau bởi lực hút liên phân tử. Các lực này đóng vai trò quan trọng trong việc tạo thành dung dịch.
Trong dung dịch thường có 3 loại tương tác:
1. Phân tử chất tan với chất tan.
2. Dung môi với dung môi.
3. Dung môi với chất tan.
Để đơn giản ta có thể hình dung quá trình hòa tan gồm ba giai đoạn sau:

Quá trình hòa tan ứng với 3 giai đoạn xảy ra đồng thời ứng với các quá trình biến đổi năng lượng
sau:
1. Tách các phân tử chất tan (DH1 ).
2. Tách các phân tử dung môi (DH2 ).
3. Quá trình solvat hóa (DH3).
Biến thiên enthalpy (nhiệt hòa tan - DHht) của quá trình hòa tan tính như sau:
. DHht có thể âm hay dương tùy thuộc vào tương quan giữa các lực liên phân tử: chất tan với chất tan, dung môi với dung môi và chất tan với dung môi. Quá trình tương tác giữa các phân tử dung môi với phân tử chất tan gọi là solvat hóa (dung môi hóa). Nếu dung môi là nước còn gọi là hydrat hóa.
cho các quá trình sau:
I.
II.
III.
Nhận định nào sau đây sai?
Quảng cáo
Trả lời:
Đáp án C
Hướng dẫn giải
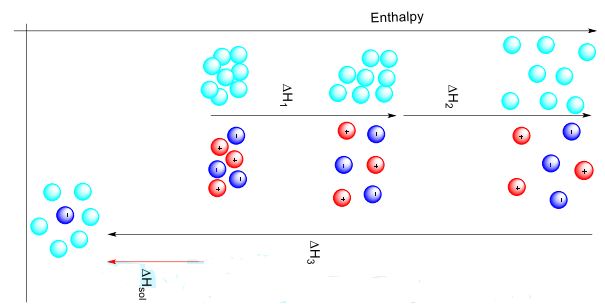
A. Đúng, do DH1 > 0 nên quá trình là thu nhiệt, cần cung cấp năng lượng để các đứt các liên kết giữa các tiểu phân.
B. Đúng, quá trình II là quá trính cắt đứt các liên kết giữa dung môi với dung môi, đồng thời sự hydrat hóa ion Mg2+ cũng diễn ra. Quá trình III là quá trình hydrat hóa anion.
C. Sai,
quá trình thu nhiệt.
D. Đúng, DHht > 0 nên quá trình thu nhiệt. Vì vậy khi dùng nước nóng sẽ cung cấp năng lượng
cho quá trình hòa tan diễn ra nhanh hơn.
Câu hỏi cùng đoạn
Câu 2:
Quan sát tiến trình và chọn ra nhận định đúng? (quan sát hình bên)

Câu 3:
Cho các phát biểu sau:
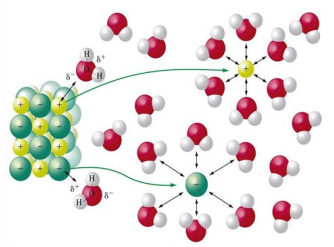
I. Tất cả các ion đều bị hydrat hóa trong dung dịch nước.
II. Sự hydrat hóa các hợp chất ion là quá trình thu nhiệt.
III. Nhiệt hydrat hóa của các cation tăng khi điện tích của cation tăng.
IV. Nhiệt hydrat hóa của các cation tăng khi bán kính của cation giảm.
V. DH1 và DH2 luôn nhận giá trị dương.
VI. Khi thì quá trình thu nhiệt.
VII. Tương tác giữa dung môi nước với các ion dương là liên kết hydrogen.
VIII. Khi bán kính anion tăng thì quá trình solvat hóa diễn ra càng thuận lợi.
IX. Tương tác giữa các ion và phân tử dung môi là tương tác có hướng và bão hòa.
X. Sau khi quá trình solvat hóa xảy ra thì giữa các phân tử dung môi sẽ không còn tương tác liên phân tử với nhau.
Số phát biểu sai là
Cho các phát biểu sau:

I. Tất cả các ion đều bị hydrat hóa trong dung dịch nước.
II. Sự hydrat hóa các hợp chất ion là quá trình thu nhiệt.
III. Nhiệt hydrat hóa của các cation tăng khi điện tích của cation tăng.
IV. Nhiệt hydrat hóa của các cation tăng khi bán kính của cation giảm.
V. DH1 và DH2 luôn nhận giá trị dương.
VI. Khi thì quá trình thu nhiệt.
VII. Tương tác giữa dung môi nước với các ion dương là liên kết hydrogen.
VIII. Khi bán kính anion tăng thì quá trình solvat hóa diễn ra càng thuận lợi.
IX. Tương tác giữa các ion và phân tử dung môi là tương tác có hướng và bão hòa.
X. Sau khi quá trình solvat hóa xảy ra thì giữa các phân tử dung môi sẽ không còn tương tác liên phân tử với nhau.
Số phát biểu sai làĐáp án B
I. Đúng, một phân tử đã điện ly thành các ion thì tất cả các ion đều bị hydrat hóa trong dung dịch nước.
II. Sai, sự hydrat các hợp chất ion thu nhiệt hoặc tỏa nhiệt phụ thuộc vào tương quan giữa các lực liên phân tử: chất tan với chất tan, nước với nước và chất tan với nước.
III. Đúng, khi ion có điện tích dương càng lớn thì tác dụng phân cực của ion càng mạnh tạo ái lực với đầu oxygen của nước càng tốt, dẫn đến tương tác giữa cation với nước càng mạnh thì nhiệt hydrat hóa càng lớn.
IV. Đúng, khi cation có bán kính càng nhỏ thì tác dụng phân cực của cation càng mạnh dẫn đến tương tác giữa cation với nước càng mạnh thì nhiệt hydrat hóa càng lớn.
* Tác dụng phân cực là khả năng kéo điện tử của các tiểu phân khác về phía mình.
V. Đúng, DH1 và DH2 luôn nhận giá trị dương do 2 giai đoạn đều là quá trình phân tách liên kết.
VI. Đúng, . (1)
Theo giản đồ: . (2)
Mà giai đoạn III là quá trình hình thành liên kết giữa anion và dung môi nên . (3)
Đồng thời: DH1 và DH2 luôn nhận giá trị dương do 2 giai đoạn đều là quá trình phân tách liên kết. (4)
Từ (1), (2), (3) và (4) => . Vì vậy quá trình hydrat hóa thu nhiệt.
VII. Sai, tương tác giữa dung môi với ion là tương tác lưỡng cực – lưỡng cực.
VIII. Đúng, khi bán kính anion tăng thì tác dụng bị phân cực tăng làm tăng tương tác giữa anion với đầu hydrogen của phân tử nước.
IX. Sai, tương tác lưỡng cực – lưỡng cực giữa ion và dung môi nước có định hượng và bất bão hòa.
X. Sai, sau khi quá trình solvat hóa diễn ra thì tạo thành một tập hợp đồng thể nên mọi tiểu phân trong hệ đều có tương tác liên phân tử với nhau.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia TP Hồ Chí Minh (2 cuốn) ( 140.000₫ )
- Tuyển tập 15 đề thi Đánh giá tư duy Đại học Bách Khoa Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội, TP Hồ Chí Minh (2 cuốn) ( 150.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án B
Hướng dẫn giải
Điểm I là tâm hình bình hành ABCD
I là trung điểm củaLời giải
Đáp án C
Hướng dẫn giải
Đại hội VI của Đảng (năm 1986) là cột mốc lịch sử quan trọng, đánh dấu việc khởi xướng công cuộc đổi mới toàn diện đất nước, chuyển đổi từ nền kinh tế tập trung quan liêu bao cấp sang nền kinh tế thị trường định hướng xã hội chủ nghĩa.
Liên hệ: Công cuộc đổi mới đã giúp Việt Nam vượt qua khủng hoảng kinh tế, từng bước hội nhập quốc tế và cải thiện đáng kể đời sống nhân dân.
Câu 3
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
A. Năng lượng sạch.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
A. Because it was famous for its rose gardens.
B. Because the sandstone cliffs have a pinkish color.
C. Because roses were a key trade item in the city.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.