Trong danh mục tiêu chuẩn chất lượng sản phẩm có chỉ tiêu về dư lượng chlorine không vượt quá 1 mg/L (chlorine sử dụng trong quá trình sơ chế nguyên liệu để diệt vi sinh vật).
Phương pháp chuẩn độ iodine-thiosulfate được dùng để xác định dư lượng chlorine trong thực phẩm theo phương trình: Cl2 + 2KI 2KCl + I2.
- Lượng I2 sau đó được được nhận biết bằng hồ tinh bột, I2 bị khử bởi dung dịch chuẩn sodium thiosulfate theo phương trình: I2 + 2Na2S2O3 2NaI + Na2S4O6.
Dựa vào thể tích dung dịch Na2S2O3 đã phản ứng, tính được lượng dư chlorine trong dung dịch mẫu.
Tiến hành chuẩn độ 100 mL dung dịch mẫu bằng dung dịch Na2S2O3 0,01M thì thể tích Na2S2O3 đã dùng trong lần chuẩn độ lần lượt như sau:
Lần
1
2
3
Thể tích Na2S2O3 đã dùng (mL)
12,65
12,6
12,6
(dụng cụ chứa dung dịch chuẩn Na2S2O3 là loại buret 25 mL, vạch chia 0,1 mL). Khối lượng Cl2 trong mẫu sản phẩm đã đem chuẩn độ ở trên là bao nhiêu mg? (Kết quả làm tròn đến hàng phần trăm).
Trong danh mục tiêu chuẩn chất lượng sản phẩm có chỉ tiêu về dư lượng chlorine không vượt quá 1 mg/L (chlorine sử dụng trong quá trình sơ chế nguyên liệu để diệt vi sinh vật).
Phương pháp chuẩn độ iodine-thiosulfate được dùng để xác định dư lượng chlorine trong thực phẩm theo phương trình: Cl2 + 2KI 2KCl + I2.
- Lượng I2 sau đó được được nhận biết bằng hồ tinh bột, I2 bị khử bởi dung dịch chuẩn sodium thiosulfate theo phương trình: I2 + 2Na2S2O3 2NaI + Na2S4O6.
Dựa vào thể tích dung dịch Na2S2O3 đã phản ứng, tính được lượng dư chlorine trong dung dịch mẫu.
Tiến hành chuẩn độ 100 mL dung dịch mẫu bằng dung dịch Na2S2O3 0,01M thì thể tích Na2S2O3 đã dùng trong lần chuẩn độ lần lượt như sau:
|
Lần |
1 |
2 |
3 |
|
Thể tích Na2S2O3 đã dùng (mL) |
12,65 |
12,6 |
12,6 |
(dụng cụ chứa dung dịch chuẩn Na2S2O3 là loại buret 25 mL, vạch chia 0,1 mL). Khối lượng Cl2 trong mẫu sản phẩm đã đem chuẩn độ ở trên là bao nhiêu mg? (Kết quả làm tròn đến hàng phần trăm).
Quảng cáo
Trả lời:
Đáp số 4,48.
Thể tích Na2S2O3 trung bình sau 3 lần chuẩn độ:
= V.CM = 0,01261667.0,01 = 1,261667.10-4 mol
Cl2 + 2KI 2KCl + I2
I2 + 2Na2S2O3 2NaI + Na2S4O6
= 6,308333.10-5 mol
= 6,308333.10-5 mol
= 6,308333.10-5.71 = 4,478917.10-3 gam = 4,478917 mg.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- Tổng ôn lớp 12 môn Toán, Lí, Hóa, Văn, Anh, Sinh Sử, Địa, KTPL (Form 2025) ( 36.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
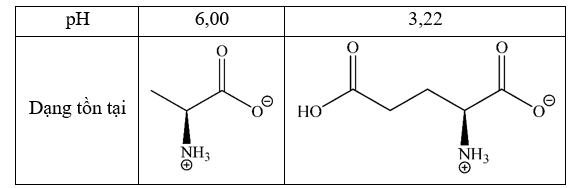
Phát biểu đúng là: (b)
(a) Sai. Vì pHglutamic = 3,22 < 10 nên glutamic tồn tại chủ yếu dưới dạng anion => di chuyển về phía cực dương.
(c) Sai. Vì pHglutamic = 3,22 < 6 nên glutamic tồn tại chủ yếu dưới dạng anion.
(d) Sai. Vì pHalanine = 6 > 2 nên alanine tồn tại chủ yếu dưới dạng cation => di chuyển về phía cực âm.
Chọn C
Lời giải
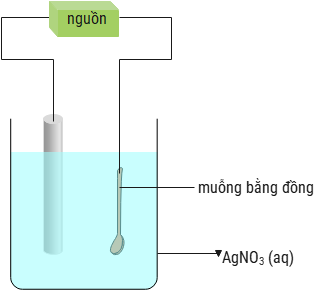
Sai. Nồng độ ion Cu2+ trong dung dịch không thay đổi theo thời gian.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.