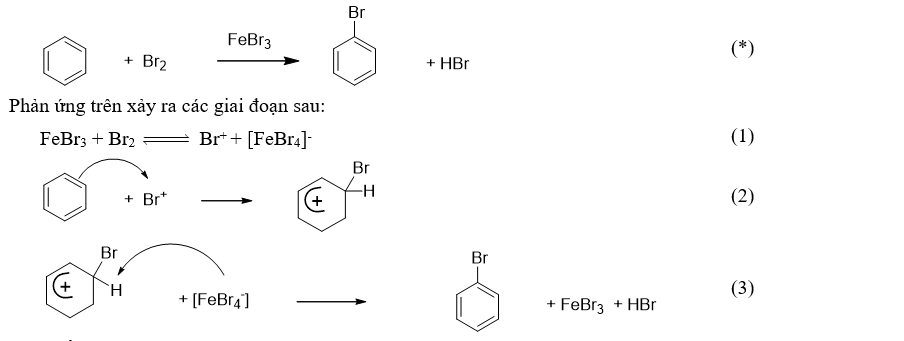
Cho đoạn thông tin sau :
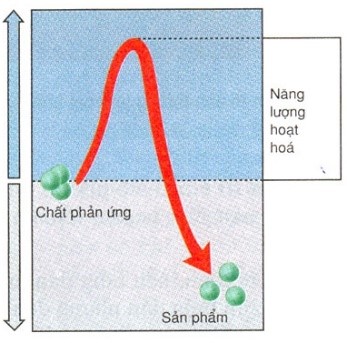
Năng lượng hoạt hóa (ký hiệu là Ea) là lượng năng lượng tối thiểu cần thiết để các phân tử phản ứng vượt qua và chuyển thành các sản phẩm trong một phản ứng hóa học. Năng lượng hoạt hóa quyết định tốc độ phản ứng:
+ Phản ứng có Ea thấp thì dễ diễn ra và nhanh chóng.
+ Phản ứng có Ea cao thì cần thêm nhiệt độ hoặc chất xúc tác để giúp phản ứng diễn ra nhanh hơn.
Vào năm 1889 bởi nhà khoa học người Thụy Điển Svante Arrhenius đưa ra phương trình liên hệ tốc độ phản ứng và năng lượng hoạt hóa như sau:
Với : k là hằng số tốc độ A: hằng số thực nghiệm Arrhenius e : logarit tự nhiên.
R là 8,314 J/K/mol T: nhiệt độ Kelvin.
Nếu ở 2 nhiệt độ T1, T2 thì phương trình liên hệ là
Chu kỳ bán rã, chu kỳ nửa phân rã hay thời gian bán rã (ký hiệu ) là thời gian cần thiết để một lượng (chất) giảm xuống còn một nửa giá trị ban đầu. Đối với phản ứng bậc 1 thì công thức tính như sau
Hãy dùng các dữ kiện trên để trả lời câu hỏi 5, 6 sau đây :
Thuốc tím (KMnO4)-potassium manganate (VII) được sử dụng để sát khuẩn, khử trùng, trị nấm cho bể cá với nồng phù hợp (tối thiểu 1 mg/mL). Nếu tiến hành thực nghiệm ở 270C thì cứ sau 15 phút nồng độ KMnO4 giảm đi một nửa và ở 370C thì sau 3 phút nồng độ KMnO4 giảm đi một nửa (giả sử phản ứng KMnO4 với các chất đều là bậc 1).
Tốc độ phản ứng tăng bao nhiêu lần khi nhiệt độ tăng từ 270C lên 370C?
Cho đoạn thông tin sau :
Năng lượng hoạt hóa (ký hiệu là Ea) là lượng năng lượng tối thiểu cần thiết để các phân tử phản ứng vượt qua và chuyển thành các sản phẩm trong một phản ứng hóa học. Năng lượng hoạt hóa quyết định tốc độ phản ứng:
+ Phản ứng có Ea thấp thì dễ diễn ra và nhanh chóng.
+ Phản ứng có Ea cao thì cần thêm nhiệt độ hoặc chất xúc tác để giúp phản ứng diễn ra nhanh hơn.
Vào năm 1889 bởi nhà khoa học người Thụy Điển Svante Arrhenius đưa ra phương trình liên hệ tốc độ phản ứng và năng lượng hoạt hóa như sau:

Với : k là hằng số tốc độ A: hằng số thực nghiệm Arrhenius e : logarit tự nhiên.
R là 8,314 J/K/mol T: nhiệt độ Kelvin.
Chu kỳ bán rã, chu kỳ nửa phân rã hay thời gian bán rã (ký hiệu ) là thời gian cần thiết để một lượng (chất) giảm xuống còn một nửa giá trị ban đầu. Đối với phản ứng bậc 1 thì công thức tính như sau
Hãy dùng các dữ kiện trên để trả lời câu hỏi 5, 6 sau đây :
Thuốc tím (KMnO4)-potassium manganate (VII) được sử dụng để sát khuẩn, khử trùng, trị nấm cho bể cá với nồng phù hợp (tối thiểu 1 mg/mL). Nếu tiến hành thực nghiệm ở 270C thì cứ sau 15 phút nồng độ KMnO4 giảm đi một nửa và ở 370C thì sau 3 phút nồng độ KMnO4 giảm đi một nửa (giả sử phản ứng KMnO4 với các chất đều là bậc 1).
Tốc độ phản ứng tăng bao nhiêu lần khi nhiệt độ tăng từ 270C lên 370C?
Quảng cáo
Trả lời:
Tại 270C (3000 K): thời gian bán hủy là 15 phút nên \(15 = \frac{{\ln 2}}{{{k_1}}} \Rightarrow {k_1} = 0,04621\,ph\'u {t^{ - 1}}\)
Tại 370C (3100 K): thời gian bán hủy là 3 phút nên \(3 = \frac{{\ln 2}}{{{k_2}}} \Rightarrow {k_2} = 0,231\,ph\'u {t^{ - 1}}\)
Như vậy tốc độ phản ứng tăng:\(\frac{{{k_2}}}{{{k_1}}} = \frac{{0,231}}{{0,0462}} = 5\)lần
Câu hỏi cùng đoạn
Câu 2:
Năng lượng hoạt hóa của phản ứng KMnO4 là bao nhiêu (làm tròn đến hàng đơn vị)?
Năng lượng hoạt hóa của phản ứng KMnO4 là bao nhiêu (làm tròn đến hàng đơn vị)?
Thế vào CT năng lượng hoạt hóa:
\(\ln \frac{{{k_1}}}{{{k_2}}} = - \frac{{{E_a}}}{R}\left( {\frac{1}{{{T_1}}} - \frac{1}{{{T_2}}}} \right) \Leftrightarrow \ln \frac{{0,0462}}{{0,231}} = - \frac{{{E_a}}}{{8,314}}\left( {\frac{1}{{300}} - \frac{1}{{310}}} \right) \Rightarrow {E_a} = 124442,06\,J = 124,44\,kJ\)
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 500 Bài tập tổng ôn Hóa học (Form 2025) ( 38.000₫ )
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
- Tổng ôn lớp 12 môn Toán, Lí, Hóa, Văn, Anh, Sinh Sử, Địa, KTPL (Form 2025) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
PTHH: nC6H4(COOH)2 + nC2H4(OH)2 → -(-OC – C6H4 – COOC2H4 – O -)n- + 2nH2O
terephthalic acid ethylene glycol Poly(ethylene terephthalate) (PET)
a. Đúng
Câu 2
Lời giải
Chọn B
Câu 3
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.