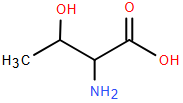
Cho phản ứng đốt cháy butane sau :
C4H10(g) + 6,5O2(g) → 4CO2(g) + 5H2O(g)
Biết năng lượng liên kết (kJ/mol) của C-C; C-H; C=O; O=O; O-H lần lượt là 346; 418; 799; 495; 467. Nhiệt dung của nước là 4,2 J/g.K và có 30% nhiệt đốt cháy butane thất thoát ra ngoài môi trường. Cần đốt cháy bao nhiêu gam C4H10 để đun 1000 gam nước từ 25°C đến 100°C (làm tròn đến hàng phần trăm) ?
Cho phản ứng đốt cháy butane sau :
C4H10(g) + 6,5O2(g) → 4CO2(g) + 5H2O(g)
Biết năng lượng liên kết (kJ/mol) của C-C; C-H; C=O; O=O; O-H lần lượt là 346; 418; 799; 495; 467. Nhiệt dung của nước là 4,2 J/g.K và có 30% nhiệt đốt cháy butane thất thoát ra ngoài môi trường. Cần đốt cháy bao nhiêu gam C4H10 để đun 1000 gam nước từ 25°C đến 100°C (làm tròn đến hàng phần trăm) ?
Quảng cáo
Trả lời:
Δr = 3.346 + 10.418 + 6,5.495 – (4.2.799 + 5.2.467) = -2626,5 kJ
nC4H10 = x, bảo toàn năng lượng:
2626,5.10³x.70% = 1000.4,2.(100 – 25)
→ x = 0,17133
→ mC4H10 = 58x = 9,94 gam
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 1200 câu hỏi lí thuyết Hóa học (Form 2025) ( 38.000₫ )
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
- Tổng ôn lớp 12 môn Toán, Lí, Hóa, Văn, Anh, Sinh Sử, Địa, KTPL (Form 2025) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
(a) Sai, thí nghiệm trên chứng minh glucose có tính chất của aldehyde.
Câu 2
Lời giải
A
Công thức phân tử của maltose là C12H22O11.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.