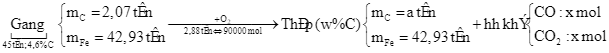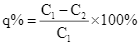Lượng nhiệt tỏa ra khi đốt cháy hoàn toàn 1 gam nhiên liệu (kí hiệu là Q, tính theo kJ g⁻¹) được sử dụng để đánh giá mức độ “giàu năng lượng” của nhiên liệu đó. Ở điều kiện chuẩn, giá trị Q của ethanol lỏng và một loại khí đốt G lần lượt là QE và QG. Cho biết: G chỉ chứa propane và butane với tỉ lệ mol tương ứng là 1: 2; nhiệt tạo thành chuẩn (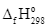 ) của các chất được cho trong bảng:
) của các chất được cho trong bảng:
Chất
C2H5OH(l)
C3H8(g)
CH3(CH2)2CH3(g)
CO2(g)
H2O(l)
O2(g)
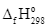 (kJ mol⁻¹)
(kJ mol⁻¹)
–277,6
–105,0
–129,0
–393,5
–285,8
0
Đặt 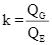 , giá trị của k bằng bao nhiêu? (Không làm tròn kết quả các phép tính trung gian, chỉ làm tròn kết quả cuối cùng đến hàng phần trăm.)
, giá trị của k bằng bao nhiêu? (Không làm tròn kết quả các phép tính trung gian, chỉ làm tròn kết quả cuối cùng đến hàng phần trăm.)
Lượng nhiệt tỏa ra khi đốt cháy hoàn toàn 1 gam nhiên liệu (kí hiệu là Q, tính theo kJ g⁻¹) được sử dụng để đánh giá mức độ “giàu năng lượng” của nhiên liệu đó. Ở điều kiện chuẩn, giá trị Q của ethanol lỏng và một loại khí đốt G lần lượt là QE và QG. Cho biết: G chỉ chứa propane và butane với tỉ lệ mol tương ứng là 1: 2; nhiệt tạo thành chuẩn (![]() ) của các chất được cho trong bảng:
) của các chất được cho trong bảng:
|
Chất |
C2H5OH(l) |
C3H8(g) |
CH3(CH2)2CH3(g) |
CO2(g) |
H2O(l) |
O2(g) |
|
|
–277,6 |
–105,0 |
–129,0 |
–393,5 |
–285,8 |
0 |
Đặt ![]() , giá trị của k bằng bao nhiêu? (Không làm tròn kết quả các phép tính trung gian, chỉ làm tròn kết quả cuối cùng đến hàng phần trăm.)
, giá trị của k bằng bao nhiêu? (Không làm tròn kết quả các phép tính trung gian, chỉ làm tròn kết quả cuối cùng đến hàng phần trăm.)
Câu hỏi trong đề: Đề chính thức thi Hóa Tốt nghiệp 2025 có đáp án (Đề 1) !!
Quảng cáo
Trả lời:
Đáp số 1,68. Chú ý: ![]()
Phương trình đốt cháy:
(1) C2H5OH(l) + 3O2(g) ![]() 2CO2(g) + 3H2O(l)
2CO2(g) + 3H2O(l)
![]() 2.(-393,5) + 3.(-285,8) – (-277,6) = -1366,8 kJ
2.(-393,5) + 3.(-285,8) – (-277,6) = -1366,8 kJ ![]() QE =
QE = ![]()
(2) C3H8(g) + 5O2(g) ![]() 3CO2(g) + 4H2O(l)
3CO2(g) + 4H2O(l)
![]() 3.(-393,5) + 4.(-285,8) – (-105) = -2218,7 kJ
3.(-393,5) + 4.(-285,8) – (-105) = -2218,7 kJ
(3) C4H10(g) + 6,5O2 ![]() 4CO2(g) + 5H2O(l)
4CO2(g) + 5H2O(l)
![]() 4.(-393,5) + 5.(-285,8) – (-129) = -2874 kJ
4.(-393,5) + 5.(-285,8) – (-129) = -2874 kJ
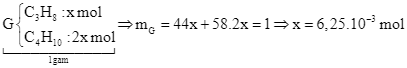
![]()
![]()
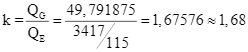
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 1200 câu hỏi lí thuyết Hóa học (Form 2025) ( 38.000₫ )
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
- Tổng ôn lớp 12 môn Toán, Lí, Hóa, Văn, Anh, Sinh Sử, Địa, KTPL (Form 2025) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Phương trình chuẩn độ: 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Hoặc bảo toàn electron: ![]() hay
hay ![]()
- Ngày thứ nhất: C1 = 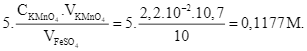
- Ngày thứ tám: C1 = 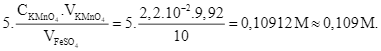
- Sự thay đổi nồng độ của Fe(II) là![]() =
= ![]()
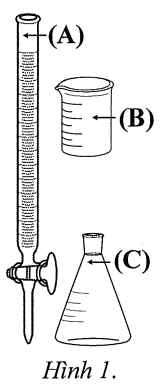
a) Sai vì phải cho vào burette (A) để xác định điểm tương đương và đo thể tích phản ứng được chính xác.
b) Sai vì q = 7,3.
c) Đúng.
d) Đúng vì sau 8 ngày nồng độ giảm FeSO4 giảm 7,3%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.